|
Diccionario de Especialidades Farmacéuticas.
Definición de Medicinas, Substancias Activas, Presentación e Indicaciones
PEGASYS
En esta página se pueden buscar definiciones de medicamentos, substancias activas, presentaciones, forma farmacéutica y formulación, indicaciones, contraindicaciones, dosis y vía de administración de casi todas las medicinas en venta.
Si desea buscar en el nombre de la medicina, hay que palomear la opción MEDICAMENTO, si quiere también buscar en la SUBSTANCIA ACTIVA o en las INDICACIONES, entonces palomear las opciones deseadas.
Por Ejemplo:
Para buscar los medicamentos INDICADOS para el resfriado o embarazo, se palomea la opción INDICACIONES y se pone en el campo de busqueda la palabra "resfriado" o "embarazo".
Para buscar los medicamentos que tengan como SUBSTANCIA ACTIVA Ibuprofeno o Piroxicam se palomea la opción SUBSTANCIA y se pone en el campo de busqueda la palabra deseada.
No usar acentos.
|
|
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
|
|
|
| Tip: Si se hace doble-click sobre una palabra, esta automáticamente se copia al campo de búsqueda. |
|
|
ROCHE,S.A. DE C.V., PRODUCTOS DIVISIÓN FARMACÉUTICA |
Av. Paseo de la Reforma Núm.2620, Col. Lomas Altas, Del. Miguel Hidalgo, 11950, México D.F.
Tels: 5258-5000 - y 5258-5125
Fax : 5258-5475
E-mail: mexico.info@roche.com
Representantes de:
Productos farmacéuticos
Tel: Helsinn,S.A.Suiza
|
|


|
PEGASYS
Solución inyectable
PEGINTERFERÓN ALFA 2A
DESCRIPCION:
PEGASYS. Indicado en el tratamiento de la hepatitis cronica C. Solucion inyectable. ROCHE
| FORMA FARMACÉUTICA Y FORMULACIÓN |
Cada frasco ámpula contiene:
Peginterferón alfa-2a (40 KD) .......................... 135 ó 180 mcg
Vehículo, c.b.p. 1 ml.
Cada jeringa precargada contiene:
Peginterferón alfa-2a (40 KD) .......................... 135 ó 180 mcg
Vehículo, c.b.p. 0.5 ml.
|
| INDICACIONES TERAPÉUTICAS |
Hepatitis crónica B: PEGASYS® está indicado para el tratamiento de la hepatitis crónica B tanto HBeAg-positiva como HBeAg-negativa, en pacientes sin cirrosis y en pacientes cirróticos con hepatopatía compensada e indicios de replicación vírica e inflamación hepática.
Hepatitis crónica C: PEGASYS® sólo o en combinación con Copegus® (ribavirina) está indicado para el tratamiento de la hepatitis crónica C en pacientes sin cirrosis y pacientes cirróticos con hepatopatía compensada.
|
| FARMACOCINÉTICA Y FARMACODINAMIA |
Propiedades y efectos:
Generalidades: El peginterferón alfa-2a (40 KD) o interferón pegilado alfa-2a (40 KD) se forma por conjugación del interferón alfa-2a con bis-monometoxipolietilenglicol. El interferón alfa-2a, producido de forma biosintética mediante ingeniería genética empleando tecnología de DNA recombinante, es el producto de un gen interferónico de leucocitos humanos clonado, insertado y expresado en bacterias de la especie Escherichia coli. La estructura del polietilenglicol (PEG) afecta directamente a las propiedades farmacológicas de PEGASYS®. Más concretamente, el tamaño y la ramificación del grupo PEG de 40 KD determina las características de absorción, distribución y eliminación de PEGASYS®.
Mecanismo de acción: PEGASYS® se caracteriza por poseer las actividades antiviral y antiproliferativa in vitro del interferón alfa-2a. Los interferones se unen a receptores específicos de la superficie celular y ponen en marcha una vía intracelular de transmisión de señales que activa rápidamente la transcripción génica. Los genes estimulados por los interferones regulan multitud de efectos biológicos; entre ellos, la inhibición de la replicación viral en las células infectadas, la inhibición de la proliferación celular y la inmunomodulación.
Los valores de ARN del VHC descienden de manera bifásica en los pacientes con hepatitis C que responden al tratamiento con PEGASYS®. La primera fase del descenso se produce dentro de las 24-36 horas siguientes a la primera dosis de PEGASYS®, y la segunda, al cabo de 4-16 semanas en los pacientes con una respuesta persistente. En comparación con el tratamiento con interferones alfa estándar, una dosis semanal de 180 mcg de PEGASYS® potencia la depuración de los viriones y mejora la respuesta virológica al final del tratamiento.
PEGASYS® promueve la maduración de células inespecíficas de la respuesta inmune, como los macrófagos y los asesinos naturales (NK), así como la estimulación de los linfocitos TCD4 y TCD8 de forma directa e indirectamente a los linfocitos B, ayudando así a la depuración viral por parte del huésped. PEGASYS® estimula la producción de proteínas efectoras, como la neopterina y la 2´,5´-oligoadenilato-sintetasa séricas, en función de la dosis. La estimulación de la 2´,5´-oligoadenilato-sintetasa es máxima después de dosis únicas de 135-180 mcg de PEGASYS® y permanece al nivel máximo durante todo el intervalo entre dosis de una semana. La magnitud y la duración de la actividad de la 2´,5´-oligoadenilato-sintetasa inducida por PEGASYS® fueron menores en los pacientes con más de 62 años de edad o en pacientes con una insuficiencia renal importante (depuración de creatinina: 20-40 ml/min). Se desconoce la trascendencia clínica de estos resultados obtenidos con marcadores farmacodinámicos de PEGASYS®.
Eficacia:
Hepatitis B: Se ha demostrado mediante estudios clínicos que la monoterapia con PEGASYS® es eficaz en el tratamiento de los pacientes con hepatitis B crónica, tanto en pacientes con HBeAg-positiva como con HBeAg-negativa/anti-HBe-positiva.
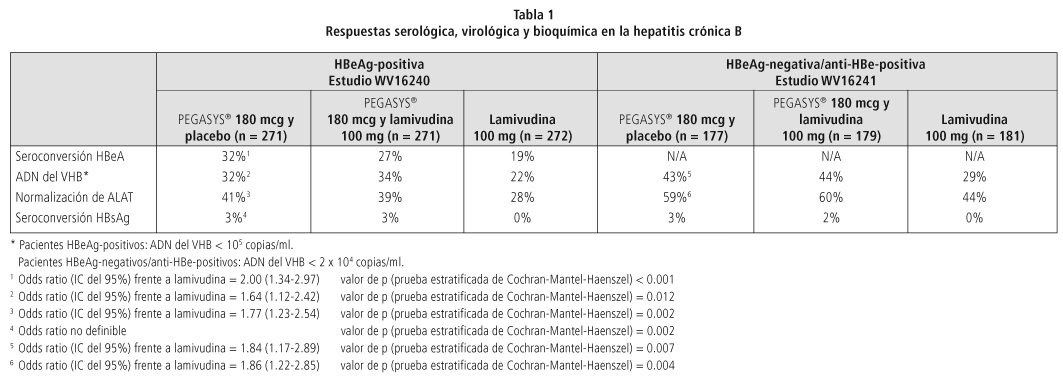
Estudios clínicos confirmatorios: En todos los estudios clínicos se reclutaron pacientes con hepatitis crónica B que presentaban replicación viral activa determinada por la medición del ADN del VHB, cifras elevadas de ALAT y una biopsia hepática compatible con hepatitis crónica. En el estudio WV16240 se incluyeron pacientes que eran positivos para HBeAg, mientras que en el estudio WV16241 se reclutaron pacientes HBeAg-negativos y anti-HBe-positivos. En ambos estudios, la duración del tratamiento fue de 48 semanas, con 24 semanas de seguimiento sin tratamiento.
En ambos estudios se compararon PEGASYS® + placebo con PEGASYS® + lamivudina y lamivudina sola. No se incluyó ningún paciente coinfectado por el VHB y el VIH en estos estudios clínicos.
La tabla 1 recoge las tasas de respuesta al final del seguimiento en ambos estudios. El ADN del VHB se determinó en una prueba COBAS AMPLICOR VHB MONITOR® (límite de detección: 200 copias/ml, equivalente a YY unidades internacionales/ml).
Hepatitis C: Se ha demostrado mediante estudios clínicos que PEGASYS® solo o en combinación con Copegus® (ribavirina) es eficaz en el tratamiento de los pacientes con hepatitis crónica C, incluidos los pacientes cirróticos con hepatopatía compensada y los pacientes coinfectados por el VIH y el VHC. Consulte la información para prescribir aprobada para las propiedades farmacodinámicas de Copegus® (ribavirina).
Estudios clínicos confirmatorios: Todos los estudios clínicos reclutaron pacientes que no habían sido previamente expuestos al interferon con hepatitis crónica C confirmada mediante niveles detectables en el suero de ARN del VHC, niveles elevados de ALAT y biopsia de hígado consistente con la hepatitis crónica. El estudio NV15495 reclutó especialmente pacientes con diagnosis histológico de cirrosis (aproximadamente 80%) o transición a cirrosis (aproximadamente 20%). Para los esquemas de dosificación, duración de la terapia y resultados del estudio, véanse las tablas 2 y 3. La respuesta virológica fue definida como ARN de VHC indetectable mediante la prueba VHC en Cobas AmplicorTM versión 2.0 (límite de detección 100 copias/ml equivalente a 50 U.I./ml) y una respuesta sostenida como una muestra negativa después de 6 meses de haber concluido la terapia.

Las respuestas virales basadas en el genotipo y la carga viral de los pacientes tratados con la terapia combinada PEGASYS® y ribavirina se resumen en la tabla 3. Los resultados del estudio NV15942 proveen la justificación del esquema de tratamiento recomendado basado en el genotipo (véase tabla 7).
La diferencia entre los esquemas de tratamiento no fue en general influenciada por la carga viral o la presencia/ausencia de cirrosis; por lo tanto, las recomendaciones del tratamiento para el genotipo 1, 2 ó 3 son independientes de estas características basales.
Se demostró adicionalmente eficacia superior de PEGASYS® comparada con interferón alfa-2a en términos de respuesta histológica, incluyendo pacientes con cirrosis, así como en pacientes coinfectados con VIH y VHC.
Coinfección por el VIH y el VHC: En el estudio NR15961, se aleatorizaron a 860 pacientes coinfectados por el VIH y el VHC y se trataron con PEGASYS® 180 mcg/semana y placebo, PEGASYS® (180 mcg/semana) y ribavirina (800 mg/día) o interferón alfa-2a (3 MUI tres veces por semana) y ribavirina (800 mg/día) durante 48 semanas, seguidas de 24 semanas de seguimiento sin tratamiento. En la tabla 4 se recogen las tasas de respuesta virológica sostenida global y por genotipo en los tres grupos terapéuticos.
Farmacocinética: La farmacocinética de PEGASYS® se ha estudiado en voluntarios sanos y pacientes infectados por el virus de la hepatitis C. Los resultados para los pacientes con hepatitis crónica B fueron similares a los de los pacientes con hepatitis crónica C.
Absorción: La absorción de PEGASYS® se prolonga hasta llegar a la concentración máxima, al cabo de 72-96 horas después de la inyección.
A las 3-6 horas de una inyección subcutánea de PEGASYS® de 180 mcg son detectables concentraciones séricas. Después de las 24 horas aproximadamente, el 80% de las concentraciones séricas máximas son alcanzadas. La biodisponibilidad absoluta de PEGASYS® es del 84%, semejante a la descrita con el interferón alfa-2a.
Distribución: En humanos, tras la administración intravenosa, PEGASYS® se encuentra principalmente en la corriente sanguínea y en los fluidos extracelulares, lo cual se aprecia en el volumen de distribución en estado estacionario (Veq) de 6 a 14 litros. Según los estudios realizados en ratas, este fármaco se distribuye por el hígado, los riñones y la médula ósea, y alcanza concentraciones altas en la sangre.
Metabolismo: El metabolismo es el mecanismo principal de eliminación para PEGASYS®, pero no se conoce con todo detalle. La depuración sistémica de PEGASYS® se sitúa en torno a los 100 ml/h en el ser humano, lo cual significa que es unas 100 veces menor que el del interferón alfa-2a natural.
Los estudios en ratas indican que los metabolitos de PEGASYS® se excretan con la orina y en menor cantidad en la bilis. Menos del 10% de una dosis se elimina por los riñones en forma de peginterferón alfa-2a intacto. Mientras la fracción PEG se mantiene unida al interferón alfa-2a, tanto PEG como el interferón alfa-2a se metabolizan.
Eliminación: Cuando PEGASYS® se administra por vía intravenosa, su vida media terminal es aproximadamente de 60 horas, frente a las 3 ó 4 horas del interferón estándar. La vida media terminal es aún mayor (aproximadamente de 80 horas, rango de 50 a 130 horas) cuando PEGASYS® se administra por vía subcutánea.
Es posible que la vida media terminal determinada tras administración subcutánea pueda no sólo reflejar directamente la fase de eliminación del fármaco, sino también la absorción prolongada de PEGASYS®.
Tanto en los voluntarios sanos como en los pacientes con hepatitis C crónica, el aumento del ABC y Cmáx fueron proporcionales a la dosis en el tratamiento con PEGASYS®, una vez a la semana. En la tabla 5 se ofrecen las variables farmacocinéticas correspondientes a PEGASYS® en voluntarios sanos que recibieron una inyección subcutánea única de 180 mcg de PEGASYS® y en pacientes con hepatitis C crónica tratados durante 48 semanas con una inyección semanal de 180 mcg de PEGASYS®.
En los pacientes con hepatitis C crónica, las concentraciones séricas de PEGASYS® en estado estacionario son 2-3 veces mayores que las registradas tras una dosis única y alcanzan el estado estacionario entre las semanas 5 y 8 de la administración semanal. Una vez alcanzado el estado estacionario, el peginterferón alfa-2a no sigue acumulándose.
Al cabo de 48 semanas de tratamiento, el cociente Cmáx/Cmín se sitúa entre el 1.5 y 2.0. Las concentraciones séricas de peginterferón alfa-2a se mantienen durante una semana completa (168 horas) [figura 1].
Farmacocinética en poblaciones especiales:
Pacientes con insuficiencia renal: No se encontró una relación significativa entre la farmacocinética de PEGASYS® y la eliminación de creatinina en 23 sujetos con función renal normal o con un daño renal significativo (eliminación de creatinina 20 a > 100 ml/min). En pacientes con enfermedad renal terminal sometidos a hemodiálisis, la eliminación disminuye en 25-45%, y dosis de 135 mcg originan una exposición similar a la alcanzada con dosis de 180 mcg en pacientes con la función renal normal.
Independientemente de la dosis inicial o el grado de insuficiencia renal, se vigilará a los pacientes y, si se producen reacciones adversas, se reducirá la dosis de PEGASYS® en la medida adecuada durante el tratamiento (véase Dosis y vía de administración). Consúltese también la información para prescribir autorizada sobre la ribavirina.
Sexo: La farmacocinética de PEGASYS® es comparable en los voluntarios sanos de uno y otro sexo.
Ancianos: El ABC es ligeramente mayor en los ancianos de 62 años, pero las concentraciones máximas son semejantes en personas mayores y menores de esa edad. De acuerdo con el grado de exposición al fármaco, la respuesta farmacodinámica y la tolerabilidad, no se requiere una dosis inicial más baja de PEGASYS® en los ancianos (véase Dosis y vía de administración).
Pacientes con y sin cirrosis: La farmacocinética de PEGASYS® es semejante en los voluntarios sanos y los pacientes con hepatitis crónica B o hepatitis crónica C. El grado de exposición y las características farmacocinéticas son también semejantes en los pacientes sin cirrosis y en los pacientes con cirrosis y hepatopatía compensada.
Lugar de administración: La administración subcutánea de PEGASYS® debe restringirse al abdomen y los muslos. La exposición a PEGASYS® era menor tras su inyección en un brazo que tras la administración en el abdomen o un muslo.
Seguridad preclínica: Los estudios de seguridad preclínica conducidos con PEGASYS® fueron limitados debido a la especificidad de las especies a los interferones. En los estudios de toxicidad aguda y crónica llevados a cabo en el simio macaco (Macaca mulatta), se encontró que los animales dosificados con peginterferón alfa-2a tuvieron resultados similares a los producidos por el interferón alfa-2a.
No se han realizado estudios de toxicidad reproductiva con PEGASYS®. Igual que sucede con otros interferones alfa, tras la administración de PEGASYS® en monos hembra se ha descrito una prolongación del ciclo menstrual. El tratamiento con interferón alfa-2a se asoció a un aumento estadísticamente significativo de la actividad abortiva en los macacos de India.
Aunque no se observaron efectos teratógenos en las crías nacidas a término, los eventos adversos en humanos no pueden ser excluidos.
PEGASYS® con ribavirina: Cuando se usó PEGASYS® en combinación con ribavirina en changos, no provocó efecto diferente al observado cuando se administró solo. El único cambio relacionado al tratamiento fue la anemia reversible leve o moderada, cuya severidad fue mayor que la producida por cualquiera de los medicamentos solos.
|
| CONTRAINDICACIONES |
PEGASYS® está contraindicado en los pacientes con antecedentes de alergia a los interferones alfa, a los productos derivados de Escherichia coli, al polietilenglicol (macrogol) o a cualquier otro componente del producto.
PEGASYS® está contraindicado en los pacientes con hepatitis autoinmune.
PEGASYS® está contraindicado en los pacientes con cirrosis descompensada.
PEGASYS® está contraindicado en pacientes coinfectados por el VIH y el VHC con cirrosis y con una puntuación ³ 6 en la clasificación de Child-Pugh.
PEGASYS® está contraindicado en los recién nacidos y los niños hasta los 3 años de edad.
La terapia combinada de PEGASYS®/ribavirina no debe utilizarse durante el embarazo. Consúltese también la información para prescribir autorizada sobre Copegus® (ribavirina) cuando PEGASYS® se emplee en terapia combinada.
|
| PRECAUCIONES GENERALES |
Pruebas de laboratorio: Antes de iniciar el tratamiento con PEGASYS® solo o en combinación con ribavirina se recomienda solicitar un análisis hematológico y bioquímico de sangre para todos los pacientes. Una vez iniciado el tratamiento, el análisis hematológico debe realizarse a las 2 y 4 semanas y el análisis bioquímico a las 4 semanas.
Los análisis adicionales se efectuarán de forma periódica mientras dure el tratamiento. Los criterios de inclusión aplicados en los estudios clínicos con PEGASYS® solo o en combinación con ribavirina pueden considerarse, de manera general, como valores aceptables para iniciar el tratamiento con PEGASYS®:
Plaquetas ³ 90,000/mm3.
Recuento absoluto de neutrófilos (RAN) ³ 1,500 células/mm3.
TSH y T4 dentro de los límites normales o función tiroidea bien controlada.
Coinfección por el VIH y el VHC: CD4 + ³ 200 µl o CD4 + ³ 100 µl-< 200 µl y ARN del VIH-1 < 5,000 copias/ml, utilizando la prueba Amplicor HIV-1 Monitor (versión 1.5).
Por lo que respecta a otros criterios de inclusión de laboratorio, consúltese la información para prescribir autorizada sobre la ribavirina. El tratamiento con PEGASYS® solo o en combinación con ribavirina se ha asociado a un descenso de la cifra total tanto de leucocitos (CSB) como de neutrófilos (RAN), que suele comenzar ya en las dos primeras semanas de tratamiento (véase Reacciones secundarias y adversas). En los estudios clínicos fueron infrecuentes los descensos progresivos después de 4 a 8 semanas de tratamiento. Se recomienda reducir la dosis de PEGASYS® si la cifra de neutrófilos desciende por debajo de 750/mm3 (véase Dosis y vía de administración). Para pacientes con valores de RAN por debajo de 500 neutrófilos/mm3, el tratamiento debe suspenderse hasta que la cifra absoluta de neutrófilos vuelva a superar los 1,000/mm3.
En los estudios clínicos con PEGASYS® o PEGASYS®/ribavirina, el descenso de la cifra de neutrófilos fue reversible tras reducir la dosis o retirar el tratamiento. El tratamiento con PEGASYS® solo o en combinación con ribavirina se ha asociado a descensos de la cifra de plaquetas que regresaron a los valores iniciales (previos al tratamiento) durante el periodo de seguimiento posterior al tratamiento (véase Reacciones secundarias y adversas). Se recomienda reducir la dosis si la cifra de plaquetas desciende por debajo de 50,000/mm3, y suspender el tratamiento si la cifra de plaquetas desciende por debajo de 25,000/mm3 (véase Dosis y vía de administración).
En estudios clínicos fue observada anemia (hemoglobina £ 10 g/dl) en el 13% de los pacientes tratados con PEGASYS®/ribavirina 1,000 ó 1,200 mg durante 48 semanas y en el 3% con PEGASYS®/ribavirina 800 mg durante 24 semanas (véase Reacciones secundarias y adversas y Alteraciones en los resultados de pruebas de laboratorio. Hemoglobina y hematocrito). El descenso máximo del valor de hemoglobina se produjo dentro de las 4 semanas siguientes al comienzo del tratamiento con ribavirina. Biometría hemática completa debe realizarse antes de empezar el tratamiento, al cabo de 2 y 4 semanas de empezado y después periódicamente. Si el estado cardiovascular experimenta un deterioro, se suspenderá o interrumpirá la administración de ribavirina (véase Dosis y vía de administración). Consúltese también la información para prescribir autorizada sobre la ribavirina.
Advertencias: PEGASYS®, solo o en terapia combinada con ribavirina, debe administrarse bajo la supervisión de un médico especialista. El tratamiento puede provocar reacciones adversas de intensidad moderada o grave que obliguen a reducir la dosis, retirar de forma temporal el tratamiento o suspenderlo de forma definitiva.
Depresión medular: Se recomienda realizar una biometría hemática completa antes del tratamiento y controlar sistemáticamente la fórmula sanguínea a lo largo del mismo. PEGASYS® solo o en combinación con ribavirina debe utilizarse con precaución en los pacientes con cifras basales de neutrófilos < 1,500/mm3, cifras basales de plaquetas < 90,000/mm3 o hemoglobina < 12 g/dl (véase Dosis y vía de administración). Al igual que con otros interferones, deben extremarse las precauciones cuando PEGASYS® deba asociarse a otros medicamentos potencialmente mielodepresores.
Infecciones: Aunque la fiebre puede asociarse al síndrome seudogripal frecuentemente notificado durante el tratamiento con interferón, es preciso descartar también otras causas de fiebre persistente, sobre todo en los pacientes con neutropenia.
Se han notificado infecciones graves (bacterianas, virales y fúngicas) durante el tratamiento con interferones alfa, incluyendo a PEGASYS®. Se instaurará de inmediato un tratamiento antiinfeccioso, adecuado y se considerará la conveniencia de suspender el tratamiento.
Efectos autoinmunes: Se han descrito exacerbaciones de las enfermedades autoinmunes en pacientes tratados con interferón alfa; PEGASYS® o PEGASYS®/ribavirina deben utilizarse con precaución en los pacientes con enfermedades autoinmunes.
La administración de interferones alfa se ha asociado a la agudización o la provocación de psoriasis. PEGASYS® solo o en combinación con ribavirina debe administrarse con precaución en pacientes con psoriasis; en caso de aparición o empeoramiento de lesiones psoriásicas, debe plantearse la posibilidad de suspender el tratamiento.
Efectos endocrinos: Como otros interferones, PEGASYS® o PEGASYS®/ribavirina pueden causar o agravar el hipotiroidismo e hipertiroidismo. Debe plantearse la posibilidad de suspender el tratamiento con PEGASYS® en los pacientes con anomalías tiroideas que no puedan tratarse de forma adecuada. Se han descrito hiperglucemia, hipoglucemia y diabetes mellitus en pacientes tratados con interferones alfa.
En el caso de estos pacientes que no puedan ser controlados médicamente de manera eficaz, no se debe iniciar la administración de PEGASYS® solo ni en combinación con ribavirina. Si estos procesos aparecen en los pacientes durante el tratamiento y no pueden controlarse con medicamentos deberá suspender el tratamiento con PEGASYS® o PEGASYS®/ribavirina.
Efectos neuropsiquiátricos: En los pacientes tratados con interferones, incluyendo PEGASYS® y PEGASYS®/ribavirina, pueden presentarse reacciones adversas graves de tipo psiquiátrico. Se han descrito casos de depresión, ideas de suicidio e intentos de suicidio en pacientes con antecedentes de enfermedad psiquiátrica y sin ellos. PEGASYS® en monoterapia o en la terapia combinada con ribavirina debe utilizarse con precaución en los pacientes con antecedentes de depresión; los médicos deben vigilar en todos los pacientes la aparición de indicios de depresión.
Antes de iniciar el tratamiento con PEGASYS® o PEGASYS®/ribavirina, los médicos deben informar a los pacientes sobre el riesgo de depresión y la necesidad de que éstos notifiquen inmediatamente cualquier signo o síntoma de depresión. En los casos graves se debe suspender el tratamiento y solicitar atención psiquiátrica (véase Reacciones secundarias y adversas).
Efectos oftalmológicos: Como con otros interferones, tras la administración de PEGASYS® se han descrito hemorragia retiniana, manchas algodonosas, edema de la papila, neuropatía óptica y obstrucción de las arterias o las venas de la retina, los cuales pueden resultar en pérdida de visión. Todos los pacientes deben tener un examen previo de los ojos.
Los pacientes con trastornos oftalmológicos pre-existentes (retinopatía diabética o hipertensiva) deben realizarse exámenes periódicos oftalmológicos durante el tratamiento con interferón alfa. Cualquier paciente que se queje de disminución o pérdida de la visión debe hacerse un examen rápido y completo. PEGASYS® o PEGASYS®/ribavirina deben suspenderse en pacientes que empeoren o desarrollen trastornos nuevos.
Efectos cardiovasculares: Debido a que la enfermedad cardiaca puede empeorar con la anemia inducida por la ribavirina, los pacientes con VHC con historia de enfermedad cardiaca inestable o significante no deben emplear Copegus® (ribavirina) en los seis meses previos. Al igual que sucede con otros interferones alfa, también con PEGASYS® y PEGASYS®/ribavirina se han descrito efectos secundarios de tipo cardiovascular, como hipertensión arterial, arritmias supraventriculares, insuficiencia cardiaca congestiva, dolor torácico e infarto de miocardio.
En caso de cardiopatía preexistente, se recomienda realizar un electrocardiograma antes de empezar el tratamiento. Si el estado cardiovascular experimenta un deterioro, el tratamiento debe suspenderse o interrumpirse [véase Dosis y vía de administración, consúltese también la información para prescribir autorizada sobre Copegus® (ribavirina)].
Reacciones de hipersensibilidad: Durante el tratamiento con interferón alfa rara vez se han observado reacciones de hipersensibilidad graves (por ejemplo: urticaria, angioedema, broncoconstricción, anafilaxia). Si se presenta una reacción tal durante el tratamiento con PEGASYS® o PEGASYS®/ribavirina, se suspenderá su administración y se instaurarán inmediatamente las medidas terapéuticas adecuadas. Exantemas transitorios no requieren la interrupción del tratamiento.
Efectos pulmonares: Como sucede con otros interferones alfa, también con PEGASYS® solo o en combinación con ribavirina se han descrito síntomas respiratorios, como disnea, infiltrados pulmonares, neumonía y neumonitis (en ocasiones mortal). En presencia de infiltrados pulmonares o insuficiencia respiratoria persistente o inexplicada, debe suspenderse el tratamiento con PEGASYS®.
Efectos hepáticos: Debe suspenderse el tratamiento con PEGASYS® o PEGASYS®/ribavirina si se presentan signos de descompensación hepática en el transcurso del tratamiento.
VHC: Igual que sucede con otros interferones alfa, también en los pacientes tratados con PEGASYS® o PEGASYS®/ribavirina se han descrito elevaciones de la ALAT con respecto a los valores basales, incluso en aquellos con respuesta virológica al tratamiento. Si la concentración de ALAT siguiera aumentando a pesar de haber reducido las dosis de PEGASYS® o si se acompañara de un aumento de la bilirrubina, debe suspenderse el tratamiento (véase Dosis y vía de administración).
VHB: A diferencia de la infección por VHC, la exacerbación de la enfermedad durante el tratamiento no es inusual, y se caracteriza por aumentos transitorios y potencialmente significativos de la ALAT en suero. Durante los estudios clínicos con PEGASYS® en la infección por el VHB, las exacerbaciones de las transaminasas se acompañaron de cambios leves en otros valores de la función hepática sin indicios de descompensación hepática.
En aproximadamente la mitad de los casos de exacerbación de más de 10 veces encima del límite superior de normalidad, se redujo o suspendió la administración de PEGASYS® hasta que los aumentos de las transaminasas remitieron, mientras que en el resto de los casos se mantuvo sin cambios el tratamiento. En todos los casos se recomendaron controles más frecuentes de la función hepática.
Coinfección por el VIH y el VHC: Los pacientes coinfectados con cirrosis en un estado avanzado que reciban a la vez TARGA pueden estar expuestos a un mayor riesgo de descompensación hepática y de muerte si se les trata con ribavirina en combinación con interferones alfa, incluyendo PEGASYS®.
Durante el tratamiento, se ha de extremar el seguimiento de los pacientes coinfectados, evaluando periódicamente el estado clínico y la función hepática, y se retirará la medicación inmediatamente en caso de descompensación (³ 7 puntos en la clasificación de Child-Pugh).
Efecto sobre la capacidad para conducir vehículos o utilizar máquinas: Si el paciente presenta mareo, confusión, somnolencia o fatiga, debe advertírsele de la conveniencia de no conducir vehículos o utilizar máquinas.
|
| RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA |
PEGASYS® no debe utilizarse en mujeres embarazadas. No se han estudiado los efectos de PEGASYS® sobre la fecundidad femenina. Igual que sucede con otros interferones alfa, tras la administración de PEGASYS® en monos hembra se ha descrito una prolongación del ciclo menstrual acompañada de descenso y retraso de las concentraciones máximas de 17ß-estradiol y progesterona. El ritmo menstrual se normalizó tras suspender el tratamiento. Tampoco se han estudiado los efectos de PEGASYS® sobre la fecundidad masculina.
No obstante, el tratamiento con interferón alfa-2a no afectó la fecundidad de los macacos de India machos (Macaca mulatta) tratados durante 5 meses con dosis de hasta 25 x 106 U.I./kg/día. No se han estudiado los efectos teratógenos de PEGASYS®. El tratamiento con interferón alfa-2a se asoció a un aumento estadísticamente significativo de la actividad abortiva en los macacos de India. No se observaron efectos teratógenos en las crías nacidas a término. No obstante, y al igual que sucede con otros interferones alfa, debe recomendarse a las mujeres en edad de procrear que sigan un método anticonceptivo eficaz mientras dure el tratamiento con PEGASYS®.
Uso con ribavirina: Se han demostrado efectos teratogénicos y/o embriocidas significativos en todas las especies animales expuestas a la ribavirina. La terapia con ribavirina está contraindicada en mujeres que están embarazadas o en las parejas de mujeres que estén embarazadas. Cuidados extremos deben tomarse para evitar el embarazo en pacientes mujeres o en las parejas de los hombres que estén tomando ribavirina.
Cualquier método anticonceptivo puede fallar. Por lo tanto es muy importante que las mujeres en edad de procrear y sus parejas empleen dos métodos anticonceptivos simultáneamente durante el tratamiento y durante 6 meses después de haber concluido el tratamiento. Consúltese también la información para prescribir aprobada sobre Copegus® (ribavirina) cuando PEGASYS® sea utilizado en combinación con ribavirina.
Lactancia: Se ignora si PEGASYS® y/o ribavirina pasan a la leche materna. Dado que muchos fármacos se eliminan con la leche materna, para evitar toda posibilidad de reacciones adversas graves en los lactantes por el efecto de PEGASYS® o ribavirina, debe decidirse entre la suspensión de la lactancia materna o el tratamiento, considerando la importancia del medicamento para la madre.
|
| REACCIONES SECUNDARIAS Y ADVERSAS |
Con PEGASYS® y PEGASYS®/ribavirina cabe esperar las reacciones adversas observadas con otros interferones alfa solos o en terapia combinada con ribavirina.
Experiencia adquirida en los estudios clínicos: La frecuencia y la intensidad de las reacciones adversas notificadas con mayor frecuencia son semejantes en los pacientes tratados con PEGASYS® o PEGASYS®/ribavirina e interferones alfa o interferones alfa con ribavirina.
Las reacciones adversas más frecuentes con PEGASYS® y PEGASYS®/ribavirina fueron en su mayoría de intensidad leve o moderada, y controlables sin necesidad de modificar la dosis o suspender el tratamiento.
Hepatitis crónica B: En los estudios clínicos de 48 semanas de tratamiento y 24 de seguimiento, el perfil toxicológico de PEGASYS® en la hepatitis crónica B fue similar al observado en la hepatitis crónica C, si bien la frecuencia de acontecimientos adversos notificados fue notablemente menor en la infección por el VHB (véase tabla 6). El 88% de los pacientes tratados con PEGASYS® experimentaron acontecimientos adversos, frente al 53% en el grupo de comparación de la lamivudina; de ellos, el 6% de los que recibieron PEGASYS® y el 4% de los tratados con lamivudina sufrieron acontecimientos adversos graves durante el estudio.
El 5% de los pacientes abandonaron el tratamiento con PEGASYS® a causa de acontecimientos adversos o alteraciones analíticas, mientras que menos del 1% abandonaron el tratamiento con lamivudina por razones de seguridad. La tasa de retirada del estudio fue semejante para los pacientes cirróticos que para el conjunto de los pacientes estudiados en cada grupo de tratamiento. La adición de lamivudina no afectó el perfil toxicológico de PEGASYS®.
Hepatitis crónica C: En los estudios clínicos, la tasa de abandonos del estudio por reacciones adversas clínicas o pruebas de laboratorio fue del 9% para PEGASYS® en monoterapia y del 13% para PEGASYS® en combinación con Copegus® (ribavirina) 1,000/1,200 mg administrados durante 48 semanas. Sólo en el 1 ó 3% de los pacientes hubo que suspender el tratamiento con PEGASYS® o PEGASYS®/ribavirina debido a alteraciones en las pruebas de laboratorio, respectivamente. La tasa de abandono del estudio fue semejante para los pacientes cirróticos que para el conjunto de los pacientes estudiados. En comparación con las 48 semanas de tratamiento con PEGASYS® y Copegus® 1,000/1,200 mg, la reducción de la exposición del tratamiento a 24 semanas y la dosis diaria de Copegus® a 800 mg provocó una reducción en los eventos adversos serios (11% vs 3%), retiros prematuros por razones de seguridad (13% vs 5%) y la necesidad de la modificación de la dosis de Copegus® (39% vs 19%).
Coinfección por el VIH y el VHC: En los pacientes coinfectados por el VIH y el VHC, los acontecimientos clínicos adversos notificados con PEGASYS®, solo o en combinación con Copegus®, fueron similares a los observados en pacientes monoinfectados por el VHC. Existen pocos datos sobre seguridad (n = 31) en pacientes coinfectados con cifras de linfocitos CD4 + < 200/µl. En el estudio NR15961, la incidencia de abandono del tratamiento por acontecimientos adversos, valores analíticos anómalos o acontecimientos definidores de sida fue del 16% en el grupo tratado con PEGASYS® en monoterapia y del 15% en el tratado con PEGASYS® y Copegus® (800 mg) en terapia combinada, durante 48 semanas. El 4% de los pacientes tratados con PEGASYS® y el 3% de los tratados con PEGASYS® y Copegus® tuvieron que suspender el tratamiento por alteraciones analíticas. En el grupo con terapia combinada se modificó la dosis de PEGASYS® en 39% y la de Copegus® en 37% de los pacientes coinfectados.
Se notificaron acontecimientos adversos graves en 21% de los pacientes con PEGASYS® en monoterapia y en 17% de los que recibieron PEGASYS® con Copegus® en terapia combinada.
La administración de PEGASYS® se asoció con un descenso del recuento absoluto de células CD4+ durante el tratamiento, pero sin una disminución del porcentaje de estos linfocitos. Las cifras de linfocitos CD4+ volvieron a los valores basales durante el periodo de seguimiento del estudio. PEGASYS® no parece tener un efecto negativo sobre el control de las cifras de VIH durante el tratamiento o el periodo de seguimiento.
En la tabla 6 se recogen las reacciones adversas observadas al menos en ³ 10% de los pacientes que han recibido PEGASYS®, PEGASYS® más ribavirina o interferón alfa-2b más ribavirina en diferentes indicaciones.
Las reacciones adversas reportadas con PEGASYS®/ribavirina en terapia combinada o PEGASYS® solo en pacientes con VHB, VHC y VIH-VHC ³ 1% pero < 10% fueron:
Infecciones: Herpes simple, infecciones urinarias, bronquitis y candidiasis oral.
Trastornos en el sistema linfático y sangre: Linfoadenopatía, anemia y trombocitopenia.
Trastornos endocrinos: Hipotiroidismo e hipertiroidismo.
Trastornos neuropsiquiátricos: Pérdida de memoria, alteración del gusto, parestesia, hipoestesia, temblor, debilidad, trastornos emocionales, alteraciones del ánimo, nerviosismo, agresión, disminución de la libido, migraña, somnolencia, hiperestesia, pesadilllas y síncope.
Trastornos visuales: Visión borrosa, xeroftalmia, inflamación ocular y dolor ocular.
Trastornos del oído: Vértigo y dolor de oído.
Trastornos cardiacos: Palpitaciones, edema periférico y taquicardia.
Trastornos vasculares: Bochorno.
Trastornos respiratorios, toráxicos y del mediastino: Dolor de garganta, rinitis, nasofaringitis, congestión sinusal, disnea de esfuerzo y epistaxis.
Trastornos gastrointestinales: Vómito, disnea, flatulencia, sequedad de boca, úlceras bucales, hemorragia gingival, estomatitis, disfagia y glositis.
Trastornos en tejido subcutáneo y piel: Trastornos de la piel, erupciones, eccema, psoriasis, urticaria, reacciones de fotosensibilidad, incremento de la sudoración y sudores nocturnos.
Trastornos musculosqueléticos, del tejido conectivo y huesos: Dolor de huesos, espalda y cuello, calambres musculares, debilidad muscular, dolor musculosquelético y artritis.
Trastornos reproductivos: Impotencia.
Trastornos generales y condiciones del sitio de administración: Síndrome pseudogripal, malestar general, letargo, sofocos, dolor del pecho y sed.
Otras reacciones adversas notificadas en ³ 1% a £ 2% de los pacientes coinfectados por el VIH y el VHC tratados con PEGASYS® y Copegus® en terapia combinada fueron: Hiperlactacidemia/lactoacidosis, gripe, neumonía, labilidad afectiva, apatía, tinnitus, dolor faringolaríngeo, queilitis, lipodistrofia adquirida y cromaturia.
Igual que sucede con otros interferones alfa, también en los pacientes tratados con PEGASYS®, sólo o en combinación con ribavirina, se han descrito en los estudios clínicos casos aislados de las siguientes reacciones adversas: infección respiratoria baja, infección cutánea, otitis externa, endocarditis, suicidio, sobredosis medicamentosa, disfunción hepática, esteatosis hepática, colangitis, neoplasia hepática maligna, úlcera péptica, hemorragia gastrointestinal, reacción pancréatica reversible (es decir, concentraciones elevadas de amilasa/lipasa, con o sin dolor abdominal), arritmia, fibrilación auricular, pericarditis, fenómenos autoinmunitarios (TP, tiroiditis, psoriasis, artritis reumatoide, SLE), miositis, neuropatía periférica, sarcoidosis, neumonitis intersticial con desenlace fatal, embolia pulmonar, úlcera corneal, coma y hemorragia cerebral.
En muy raras ocasiones, la administración de interferones alfa, incluyendo a PEGASYS® en monoterapia o en combinación con ribavirina, puede acompañarse de pancitopenia (anemia aplásica).
|
| INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO |
No se han observado interacciones farmacocinéticas entre PEGASYS® y Copegus® (ribavirina) en los estudios clínicos con VHC, en los que PEGASYS® se utilizó en combinación con la ribavirina.
De la misma manera, lamivudina no tuvo ningún efecto en la farmacocinética de PEGASYS® en estudios clínicos con VHB en los cuales éste fue empleado en combinación con lamivudina.
En sujetos sanos de sexo masculino, el tratamiento con PEGASYS® en una dosis de 180 mcg una vez por semana durante 4 semanas no afectó la farmacocinética de la tolbutamida (CYP 2C9), mefenitoína (CYP 2C19), debrisoquina (CYP 2D6) y dapsona (CYP 3A4). PEGASYS® inhibe ligeramente el citocromo P-450 1A2, puesto que se observó un aumento del 25% en el ABC de la teofilina en el mismo estudio.
Efectos comparables en la farmacocinética de la teofilina se han descrito tras el tratamiento con interferones alfa estándar. Se ha puesto de manifiesto que los interferones alfa influyen en el metabolismo oxidativo de algunos medicamentos, disminuyendo la actividad enzimática del sistema citocromo P-450 en los microsomas hepáticos. En los pacientes tratados simultáneamente con teofilina y PEGASYS® o PEGASYS®/ribavirina, deben determinarse periódicamente las concentraciones séricas de teofilina para poder efectuar los ajustes necesarios de la dosis de teofilina. En un estudio farmacocinético de 24 pacientes con VHC que recibieron concomitantemente terapia de mantenimiento con metadona (dosis media 95 mg; rango de 30 a 150 mg), el tratamiento con 180 mcg de PEGASYS® por vía subcutánea una vez a la semana durante 4 semanas se asoció con una media en los niveles de la metadona de 10 a 15% mayores a la línea basal.
La significancia clínica de este hallazgo es desconocida; sin embargo, los pacientes deben ser monitoreados para detectar signos y síntomas de intoxicación por metadona. No se observó ninguna evidencia de la interacción de medicamentos en 47 pacientes coinfectados con VIH y VHC que completaron un subestudio farmacocinético de 12 semanas para examinar el efecto de la ribavirina en la fosforilación intracelular de algunos nucleótidos inhibidores de la transcriptasa inversa (lamivudina, zidovudina, o stavudina).
La exposición plasmática de la ribavirina no aparece ser afectada por la administración concomitante de NITI. La coadministración de ribavirina y didanosina no se recomienda. La exposición a didanosina o su metabolito activo (dideoxiadenosin 5´-trifosfato) se incrementa cuando la didanosina es coadministrada con ribavirina. Los reportes de falla hepática fatal, así como neuropatía periferal, pancreatitis e hipercalcemia sintomática/acidosis láctica han sido reportados con el uso de ribavirina.
|
| ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO |
Por lo que respecta a la terapia combinada en pacientes con VHC para los efectos de la ribavirina sobre los valores de las pruebas de laboratorio, consúltese la información para prescribir autorizada.
Hematología: Como sucede con otros interferones, el tratamiento con PEGASYS® o PEGASYS®/ribavirina se ha asociado a un descenso de los valores hematológicos, que suelen mejorar tras modificar la dosis y regresan a los valores previos al tratamiento en un plazo de 4 a 8 semanas tras suspender el tratamiento (véase Precauciones generales, y Dosis y vía de administración).
A pesar de que las toxicidades hematológicas de neutrocitopenia, trombocitopenia y anemia fueron más frecuentes en los pacientes coinfectados por el VIH y el VHC, la mayoría de éstas pudieron corregirse mediante la modificación de la dosis y el uso de factores de crecimiento y en pocas ocasiones fue necesaria la suspensión del tratamiento.
Hemoglobina y hematocrito: Aunque el tratamiento con PEGASYS® en monoterapia se ha asociado a un ligero descenso gradual de la hemoglobina y el hematocrito, en menos del 1% de todos los pacientes con VHC, incluidos los cirróticos, fue necesario modificar la dosis debido a la anemia. De los pacientes tratados con dosis de 1,000/1,200 mg de PEGASYS®/ribavirina en terapia combinada durante 48 semanas, fue necesario reducir la dosis debido a anemia en 10%, aproximadamente. De los pacientes coinfectados por el VIH y el VHC, se notificó anemia (hemoglobina < 10 g/dl) en el 7% de los tratados con PEGASYS® en monoterapia y en el 14% de los que recibieron terapia combinada con Copegus®.
Leucocitos: El tratamiento con PEGASYS® se ha asociado a disminución de las cifras totales de lecucocitos y neutrófilos. Aproximadamente, el 4% de los pacientes con VHB o VHC que recibieron PEGASYS® y 5% de los pacientes con VHC que recibieron PEGASYS®/ribavirina presentaron disminuciones del recuento absoluto de neutrófilos por debajo de las 500 células/mm3 en algún momento del tratamiento.
Entre los pacientes coinfectados por el VIH y el VHC, el 13% de los que recibieron PEGASYS® en monoterapia y el 11% de los que recibieron la terapia combinada presentaron descensos del recuento absoluto de neutrófilos por debajo de 500 células/mm3.
Plaquetas: El tratamiento con PEGASYS® se ha asociado a disminución de las cifras de plaquetas. En los estudios clínicos, aproximadamente el 5% de los pacientes con VHC presentaron reducciones de la cifra de plaquetas por debajo de 50,000/mm3; en su mayor parte se trataba de pacientes con cirrosis que entraron en el estudio con cifras basales de tan sólo 75,000 plaquetas/mm3.
En los estudios clínicos para la hepatitis B, el 14% de los pacientes experimentaron descensos de la cifra de plaquetas por debajo de 50,000/mm3; la mayoría fueron pacientes con un recuento plaquetario basal bajo al entrar en el estudio. En los pacientes coinfectados por el VIH y el VHC, el 10% de los que recibieron PEGASYS® en monoterapia y el 8% de los que recibieron la terapia combinada presentaron descensos de la cifra de plaquetas por debajo de 50,000/mm3.
Función tiroidea: El tratamiento con PEGASYS® se ha asociado a alteraciones clínicamente significativas de las pruebas funcionales tiroideas que exigen intervención médica (véase Precauciones generales). La frecuencia de alteraciones tiroideas observadas con PEGASYS® es semejante a la descrita con otros interferones.
Triglicéridos: Se han encontrado niveles de triglicéridos altos en pacientes que reciben la terapia con interferón alfa, incluyendo PEGASYS®.
Anticuerpos anti-interferón: El tres por ciento de los pacientes con VHC (25/835) que recibieron PEGASYS® con o sin Copegus® (ribavirina) desarrollaron bajos títulos de anticuerpos neutralizantes antiinterferon. La significancia clínica o patológica de la aparición de anticuerpos neutralizantes en suero, se desconoce. No se observó una aparente correlación entre el desarrollo de anticuerpos y la respuesta clínica o los eventos adversos.
|
| PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD |
Carcinogénesis y mutagénesis: No se ha estudiado el potencial carcinogénico de PEGASYS®. El peginterferón alfa-2a no fue mutagénico ni clastógeno en la prueba de mutagenicidad de Ames ni en la prueba in vitro de aberraciones cromosómicas en linfocitos humanos, ni con activación metabólica ni en ausencia de ésta. No se han estudiado los efectos teratógenos de PEGASYS®.
El tratamiento con interferón alfa-2a se asoció a un aumento estadísticamente significativo de la actividad abortiva en los macacos de India. No se observaron efectos teratógenos en las crías nacidas a término. No obstante, y al igual que sucede con otros interferones alfa, debe recomendarse a las mujeres en edad de procrear que sigan un método anticonceptivo eficaz mientras dure el tratamiento con PEGASYS®.
Uso con ribavirina: Se han demostrado efectos teratogénicos y/o embriocidas significativos en todas las especies animales expuestas a la ribavirina. La terapia con ribavirina está contraindicada en mujeres que están embarazadas o en las parejas de mujeres que estén embarazadas. Cuidados extremos deben tomarse para evitar el embarazo en pacientes mujeres o en las parejas de los hombres que estén tomando ribavirina. Cualquier método anticonceptivo puede fallar. Por lo tanto, es muy importante que las mujeres en edad de procrear y sus parejas empleen dos métodos anticonceptivos simultáneamente durante el tratamiento y durante 6 meses después de haber concluido el tratamiento. Consúltese también la información para prescribir aprobada sobre Copegus® (ribavirina) cuando PEGASYS® sea utilizado en combinación con ribavirina.
|
| DOSIS Y VÍA DE ADMINISTRACIÓN |
Dosis habitual:
Hepatitis B crónica: La dosis recomendada de PEGASYS® en la hepatitis crónica B tanto HBeAg-positiva como HBeAg-negativa es de 180 mcg una vez por semana, por administración subcutánea en el abdomen o en el muslo. La duración recomendada del tratamiento es de 48 semanas.
Hepatitis C crónica: La dosis recomendada de PEGASYS®, solo o en combinación con Copegus® (ribavirina), es de 180 mcg en inyección subcutánea una vez por semana en el abdomen o muslo. Copegus® debe ser administrado con comida.
La duración recomendada de la monoterapia con PEGASYS® es de 48 semanas. La duración de la terapia combinada y la dosis diaria de Copegus® administrado en combinación con PEGASYS® debe ser individual basada en el genotipo viral del paciente (véase Tabla 7).
Coinfección por el VIH y el VHC: La dosis recomendada de PEGASYS®, solo o en combinación con 800 mg de Copegus® (ribavirina), es de 180 mcg una vez por semana, administrada por vía subcutánea durante 48 semanas, independientemente del genotipo. No se ha estudiado la seguridad y eficacia del tratamiento combinado con Copegus® en dosis superiores a 800 mg diarios o durante un periodo inferior a 48 semanas.
Predictibilidad de la respuesta y la no respuesta: La respuesta virológica temprana en la semana 12, definida como un decremento de la carga viral de 2 log o niveles no detectables de ARN del VHC, se ha mostrado como factor de pronóstico de la respuesta sostenida (véase tabla 8).
El valor pronóstico negativo de una respuesta sostenida en pacientes con VHC tratados con monoterapia de PEGASYS® fue del 98%. En los pacientes coinfectados por el VIH y el VHC tratados con PEGASYS® en monoterapia o en combinación con Copegus® se han observado, valores pronóstico negativos similares (100 ó 98%, respectivamente). En los pacientes coinfectados por el VIH y el VHC que recibieron la terapia combinada, se han observado valores pronóstico positivos del 45% en el caso del genotipo 1 y de 70% con los genotipos 2 y 3.
Pautas posológicas especiales
Modificación de la dosis para PEGASYS®:
Reacciones adversas generales: En presencia de reacciones adversas (clínicas o exámenes de laboratorio) de intensidad moderada o grave, en la mayor parte de los casos basta con reducir la dosis inicial a 135 mcg. En ocasiones, no obstante, puede ser necesario reducir la dosis a 90 mcg o 45 mcg. Una vez que haya cedido el efecto secundario, puede plantearse la posibilidad de volver a aumentar la dosis (Precauciones generales/Advertencias y Reacciones secundarias y adversas).
Alteraciones hematológicas: Se recomienda reducir la dosis si el recuento absoluto de neutrófilos (RAN) es menor de 750 células/mm3. En los pacientes con cifras de RAN inferiores a 500 células/mm3, el tratamiento con PEGASYS® debe suspenderse hasta que las cifras del RAN se recuperen por encima de las 1,000 células/mm3. La terapia puede reiniciarse con 90 mcg de PEGASYS® y el recuento de los neutrófilos monitoreado.
Se recomienda reducir la dosis de PEGASYS® a 90 mcg si la cifra de trombocitos (plaquetas) desciende por debajo de 50,000/mm3. Se recomienda suspender por completo el tratamiento si la cifra de plaquetas desciende por debajo de 25,000/mm3.
Función hepática: En los pacientes con hepatitis crónica son frecuentes las fluctuaciones de las pruebas funcionales hepáticas; sin embargo, al igual que con otros interferones alfa, se han descrito elevaciones de la ALAT con respecto a los valores basales en los pacientes tratados con PEGASYS®, incluso en los pacientes con respuesta virológica al tratamiento.
En los pacientes infectados con el virus de la hepatitis C (VHC), en presencia de aumentos progresivos de la ALAT con respecto a los valores iniciales, la dosis debe reducirse inicialmente a 135 mcg. Si la concentración de ALAT siguiera aumentando a pesar de haber reducido la dosis de PEGASYS®, o si se acompañara de un aumento de la bilirrubina o signos de descompensación hepática, debe suspenderse por completo el tratamiento (véase Precauciones generales/Advertencias).
En los pacientes infectados con el virus de la hepatitis B (VHB), no son inusuales exacerbaciones transitorias de la ALAT, en ocasiones de más de 10 veces por encima del límite superior de la normalidad, las cuales pueden reflejar el aclaramiento viral por el sistema inmunitario. Se considera la conveniencia de proseguir el tratamiento controlando con más frecuencia la función hepática, durante las exacerbaciones de la ALAT. Si se reduce o suspende la administración de PEGASYS®, el tratamiento podrá establecerse una vez que haya remitido la exacerbación.
Modificación de la dosis de Copegus® cuando se administre la terapia combinada: Para el manejo del tratamiento de la anemia emergente, en terapia combinada, la dosis de Copegus® debe reducirse 200 mg de la dosis inicial si cualquiera de lo siguiente aplica:
Un paciente sin enfermedad cardiovascular significante experimenta una caída en la hemoglobina < 10 g/dl y ³ 8.5 g/dl o
Un paciente con enfermedad cardiovascular estable experimenta una caída en la hemoglobina ³ 2 g/dl durante el tratamiento.
Copegus® debe descontinuarse en las siguientes circunstancias:
Si un paciente sin enfermedad cardiovascular significativa experimenta un decremento confirmado en la hemoglobina < 8.5 g/dl.
Si un paciente con una enfermedad cardiovascular estable mantiene un valor de hemoglobina < 12 g/dl a pesar de estar 4 semanas con una dosis reducida.
Tras la suspensión de Copegus® a un paciente debido a una alteración en los parámetros de laboratorio o una manifestación clínica, se puede intentar reiniciar el tratamiento con 600 mg/día de Copegus® y posteriormente aumentar la dosis a 800 mg/día si el médico así lo estima. Sin embargo, no es aconsejable aumentar la dosis de Copegus® hasta la dosis original (1,000 mg ó 1,200 mg).
En caso de intolerancia a Copegus®, la monoterapia con PEGASYS® puede ser continuada.
Poblaciones especiales:
Insuficiencia renal: A los pacientes con insuficiencia renal en estado terminal se les debe administrar una dosis inicial de PEGASYS® de 135 mcg, una vez por semana (véase Farmacocinética y farmacodinamia en poblaciones especiales). Independientemente de la dosis inicial o el grado de insuficiencia renal, se vigilará a los pacientes y, si se producen reacciones adversas, se reducirá la dosis de PEGASYS® en la medida adecuada durante el tratamiento. Por lo que respecta al uso con Copegus® (ribavirina) en pacientes con insuficiencia renal, consúltese la información para prescribir autorizada sobre la ribavirina.
Insuficiencia hepática: Se ha demostrado la eficacia e inocuidad de PEGASYS® en los pacientes con cirrosis compensada (por ejemplo estadio A de Child-Pugh).
No se ha estudiado PEGASYS® en pacientes con cirrosis descompensada (por ejemplo, estadio B/C de Child-Pugh o várices esofágicas sangrantes) (véase Contraindicaciones).
La clasificación de Child-Pugh divide los pacientes en tres grupos: A, B y C, o leve, moderado y severo, con una equivalencia en puntos de 5-6, 7-9 y 10-15, respectivamente.
Evaluación modificada:
Niños: No se ha determinado aún la eficacia ni la toxicidad de PEGASYS® en los pacientes menores de 18 años. Además, las soluciones inyectables de PEGASYS® contienen alcohol bencílico. Se han descrito casos aislados de muerte en recién nacidos y niños asociados con la exposición excesiva al alcohol bencílico.
Se desconoce la cantidad exacta de alcohol bencílico que provoca toxicidad o reacciones adversas en los recién nacidos y niños. No se recomienda, por lo tanto, administrar PEGASYS® a los recién nacidos y los niños (véase Contraindicaciones).
Ancianos: De acuerdo con los datos de farmacocinética, farmacodinamia, tolerabilidad y seguridad obtenidos en los estudios clínicos, no se requiere ninguna modificación especial de la dosis de PEGASYS® en los ancianos.
Manejo eliminación: Los fármacos para uso parenteral deben someterse a inspección visual previa a su administración para confirmar la ausencia de partículas o cambios de color, siempre que el tipo de recipiente y el tipo de solución lo permitan.
En caso de uso doméstico, debe entregarse a los pacientes un recipiente imperforable para eliminar las jeringas y agujas usadas. Debe concientizarse a los pacientes sobre la importancia de eliminar correctamente las jeringas y agujas usadas, así como la importancia de evitar su reutilización. Una vez lleno el recipiente, debe eliminarse según las indicaciones recibidas del médico.
Incompatibilidades: No debe mezclarse PEGASYS® con otros productos.
|
| MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL |
Se han descrito sobredosis de PEGASYS® desde dos inyecciones en días consecutivos (en lugar del intervalo semanal recomendado) hasta la administración de inyecciones diarias durante una semana (esto es: 1,260 mcg/semana). Ninguno de estos pacientes presentó efectos secundarios imprevistos, de carácter grave o limitante de tratamiento.
Se han administrado dosis semanales de hasta 540 mcg en los estudios clínicos con adenocarcinoma renal y de hasta 630 mcg en los estudios clínicos con leucemia mielógena crónica. La toxicidad limitada a la dosis provocó fatiga, elevación de las enzimas hepáticas, neutropenia y trombocitopenia como cabría esperar de un tratamiento interferónico. No se han reportado casos de sobredosificación por Copegus® en estudios clínicos. Para datos más amplios, consúltese la información para prescribir aprobada sobre Copegus® (ribavirina).
|
| PRESENTACIONES |
Caja con 1 ó 4 frascos ámpula con 135 mcg/ml y 180 mcg/ml.
Caja con 1 ó 4 jeringas precargadas con 135 mcg/0.5 ml y 180 mcg/0.5 ml.
|
| RECOMENDACIONES SOBRE ALMACENAMIENTO |
Consérvese en refrigeración entre 2 y 8°C.
No se congele.
No se agite.
Consérvese el frasco ámpula o jeringa precargada en su empaque original bien cerrado.
Protéjase de la luz.
|
| LEYENDAS DE PROTECCIÓN |
No se deje al alcance de los niños.
Su venta requiere receta médica.
Este medicamento deberá ser administrado únicamente por médicos especialistas.
Hecho en Suiza por:
F. Hoffmann-La Roche, S. A., Basilea
Acondicionado y distribuido por:
PRODUCTOS ROCHE, S. A. de C. V.
Reg. Núm. 340M2001, SSA IV
BEAR-05330020510028/RM2005
Fecha de autorización: 23 de febrero de 2005
|
|
|