|
Diccionario de Especialidades Farmacéuticas.
Definición de Medicinas, Substancias Activas, Presentación e Indicaciones
PEGTRON
En esta página se pueden buscar definiciones de medicamentos, substancias activas, presentaciones, forma farmacéutica y formulación, indicaciones, contraindicaciones, dosis y vía de administración de casi todas las medicinas en venta.
Si desea buscar en el nombre de la medicina, hay que palomear la opción MEDICAMENTO, si quiere también buscar en la SUBSTANCIA ACTIVA o en las INDICACIONES, entonces palomear las opciones deseadas.
Por Ejemplo:
Para buscar los medicamentos INDICADOS para el resfriado o embarazo, se palomea la opción INDICACIONES y se pone en el campo de busqueda la palabra "resfriado" o "embarazo".
Para buscar los medicamentos que tengan como SUBSTANCIA ACTIVA Ibuprofeno o Piroxicam se palomea la opción SUBSTANCIA y se pone en el campo de busqueda la palabra deseada.
No usar acentos.
|
|
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
|
|
|
| Tip: Si se hace doble-click sobre una palabra, esta automáticamente se copia al campo de búsqueda. |
|
|
SCHERING-PLOUGH, S.A. DE C.V. |
Av. 16 de Septiembre Núm. 301,Col. Xaltocan, Deleg. Xochimilco 16090 México D.F.
Tel.: 5728-4444
|
|


|
PEGTRÓN
Pluma monodosis precargada
Polvo para solución inyectable
PEGINTERFERÓN ALFA 2B
DESCRIPCION:
PEGTRON. Indicado para el tratamiento de la hepatitis C cronica. Pluma monodosis precargada, Polvo para solucion inyectable. SCHERING-PLOUGH
| FORMA FARMACÉUTICA Y FORMULACIÓN |
Cada frasco ámpula con liofilizado contiene:
Peginterferón
alfa-2b....................................................................... 50, 80, 100, 120 y 150 mcg
Excipiente, c.s.
La ampolleta con diluyente contiene: agua estéril inyectable 0.7 ml. Cada pluma monodosis precargada de PEGTRÓN® con 0.5 ml contiene:
Peginterferón
alfa-2b....................................................................... 50, 80, 100, 120 y 150 mcg
Excipiente, c.s. PEGTRÓN® Polvo liofilizado para preparar solución inyectable está disponible en frasco ámpula de 50, 80, 100, 120 y 150 mcg de peginterferón alfa-2b, que es un conjugado covalente de interferón alfa-2b recombinante con monometoxi polietilenglicol. El peso molecular promedio de la porción pegilada es de 12,000 daltons, mientras que el peso promedio de PEGTRÓN® es de aproximadamente 31,300 daltons. El interferón alfa-2b es obtenido de una clona de E.coli que contiene un plásmido híbrido con el gen de interferón alfa-2b de leucocitos humanos y producido por ingeniería genética. Una vez reconstituido, cada frasco ámpula provee 0.5 ml de solución de PEGTRÓN®. La pluma monodosis precargada de PEGTRÓN® provee en 0.5 ml de solución de PEGTRÓN 50, 80, 100, 120 y 150 mcg lista para aplicarse. |
| INDICACIONES TERAPÉUTICAS |
PEGTRÓN ® y PEGTRÓN® Pluma monodosis precargada están indicados para el tratamiento de la hepatitis C crónica. Los pacientes deben tener más de 18 años y una enfermedad hepática compensada. La combinación de PEGTRÓN® con ribavirina se considera el tratamiento óptimo para la hepatitis C crónica. (Véase Información relacionada con ribavirina y/o la presentación respectiva a la terapia combinada).
Estudios clínicos: Los resultados de un extenso estudio clínico multicéntrico, aleatorizado, fase III, demostraron la eficacia y seguridad de PEGTRÓN® en el tratamiento de pacientes con hepatitis C crónica.
Se incluyeron 1,219 pacientes; los objetivos del estudio fueron evaluar la eficacia y seguridad del tratamiento a 48 semanas, en una de tres dosis de PEGTRÓN® (0.5, 1.0, 1.5 mcg/kg administrados una vez a la semana por vía subcutánea) versus interferón convencional (3 M.U.I. de interferón alfa-2b administrados por vía subcutánea tres veces a la semana).
Los pacientes incluidos tenían estudio de reacción en cadena de la polimerasa (PCR) para RNA-VHC positiva (> 100 copias/ml), una biopsia hepática consistente con un diagnóstico histológico de hepatitis crónica, sin ninguna otra causa para hepatitis crónica, y anormalidad en la determinación de ALAT. Las medidas primarias de eficacia fueron la respuesta virológica (disminución del RNA-VHC < 100 copias/ml) y la respuesta bioquímica (normalización de ALAT) 6 meses después de completar un año de tratamiento. Con base en la respuesta virológica, todas las dosis de PEGTRÓN® fueron estadísticamente superiores a la dosis de interferón convencional (tabla 1).
* RNA-VHC sérico es medido por reacción de la polimerasa en cadena con un límite inferior de detección de 100 copias/ml.
** Prueba Chi cuadrada.
La calidad de vida fue menos afectada con la dosis de 0.5 mcg/kg de PEGTRÓN® que la dosis de 1.0 mcg/kg, una vez a la semana y que la de 3 M.U.I. de interferón alfa-2b, tres veces a la semana.
Terapia combinada: Se realizó un estudio clínico aleatorizado pivote con PEGTRÓN®, donde se compararon dos esquemas combinados con rivabirina versus interferón convencional y ribavirina. Los pacientes incluidos tenían diagnóstico de hepatitis C confirmado por estudio de reacción en cadena de la polimerasa (PCR) para RNA-VHC positiva (> 100 copias/ml), biopsia hepática consistente con un diagnóstico histológico de hepatitis crónica, sin ninguna otra causa para hepatitis crónica, y anormalidad en la determinación de ALAT.
En este estudio 1,530 pacientes vírgenes a tratamiento recibieron uno de los siguientes regímenes combinados:
Peginterferón alfa-2b (1.5 mcg/kg/semana) + ribavirina cápsulas (800 mg/día) (n = 511).
Peginterferón alfa-2b (1.5 mcg/kg/semana por un mes, seguido de 0.5 mcg/kg/semana por 11 meses) + ribavirina cápsulas (1,000/1,200 mg/día) (n = 514).
Interferón convencional (3 M.U.I. tres veces a la semana) + ribavirina (1,000/1,200 mg/día) (n = 505).
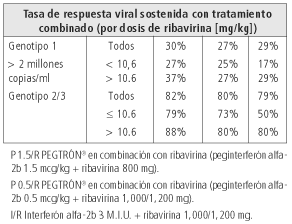
El tratamiento con PEGTRÓN® terapia combinada fue significativamente más efectivo que la combinación de interferón alfa-2b convencional y ribavirina, particularmente en pacientes infectados con genotipo 1 (tabla 2). La respuesta sostenida fue evaluada por la tasa de respuesta a los 6 meses de finalizado el tratamiento.
Es conocido que el genotipo del virus de la hepatitis C y la carga viral inicial son factores de pronóstico que afectan las tasas de respuesta.
Sin embargo, en este estudio se demostró que las tasas de respuesta fueron dependientes de la dosis de ribavirina administradas en la combinación.
La tasa de respuesta en pacientes que recibieron > 10.6 mg/kg de ribavirina (dosis de 800 mg en el paciente de 75 kg), independientemente del genotipo o la carga viral fueron significativamente mayores que para los pacientes que recibieron < 10.6 mg/kg de ribavirina (tabla 1). La tasa de respuesta en pacientes que recibieron > 13.2 mg/kg de ribavirina fue aún mayor.
El beneficio de la combinación de PEGTRÓN® fue evidente para pacientes con o sin cirrosis (55%) y para aquellos con cambios mínimos de fibrosis (61%).
En pacientes con cirrosis en desarrollo o cirrosis, la respuesta viral sostenida fue más alta con la combinación de peginterferón alfa-2b y ribavirina que en los que recibieron ribavirina combinada con interferón alfa-2b convencional (55% vs 43%).
En este estudio, la tasa de respuesta fue incrementada en pacientes capaces de mantener el apego al tratamiento. Independientemente del genotipo, los pacientes que recibieron el régimen de combinación y que recibieron > 80% de su tratamiento con peginterferón alfa-2b y ribavirina tuvieron una respuesta sostenida mayor 6 meses después de un año de tratamiento que aquellos que tomaron < 80% de su tratamiento (72% vs 46%).
P 1.5/R PEGTRÓN® en combinación con ribavirina (peginterferón alfa-2b 1.5 mcg/kg + ribavirina 800 mg).
P 0.5/R PEGTRÓN® en combinación con ribavirina (peginterferón alfa-2b 0.5 mcg/kg + ribavirina 1,000/1,200 mg).
I/R Interferón alfa-2b 3 M.I.U. + ribavirina 1,000/1,200 mg.
La dosis de ribavirina a utilizar en combinación con peginterferón alfa-2b se basa en el peso corporal del paciente (tabla 3). Las cápsulas de ribavirina deben ser administradas por vía oral diariamente en dos dosis divididas con los alimentos (mañana y noche).
El perfil de seguridad de PEGTRÓN® es el mismo del interferón convencional. Generalmente la incidencia y severidad de los eventos adversos fueron similares entre los pacientes tratados con PEGTRÓN® 0.5 mcg/kg y aquéllos tratados con interferón convencional, la dosis de 3 M.U.I., tres veces a la semana. Los dos esquemas de tratamiento resultaron en menores eventos adversos comparados con las dosis de 1.0 y 1.5 mcg/kg de PEGTRÓN®. La incidencia y severidad de los eventos adversos en los grupos con dosis más altas de PEGTRÓN® fueron similares entre ellos. La mayoría de los eventos fueron de leves a moderados en severidad y no limitaron el tratamiento. Existe una toxicidad adicional limitada cuando se extendió el tratamiento a un año en todas las dosis. En la mayoría de los casos se implementaron modificaciones en las dosis y los pacientes pudieron finalizar el curso del tratamiento.
La seguridad de PEGTRÓN® y en terapia combinada fue evaluada con datos de un estudio aleatorizado en el cual los pacientes fueron tratados por un año con uno de dos diferentes esquemas de dosis. El grupo control en este estudio recibió interferón alfa-2b (3 M.U.I. 3 veces por semana) + ribavirina (100/1,200 mg/día) por un año. Los eventos adversos reportados > 10% de los pacientes que recibieron el régimen recomendado de PEGTRÓN® terapia combinada en este estudio se muestran en la información de la presentación para terapia combinada o bien, consultar la información relativa a ribavirina. |
| FARMACOCINÉTICA Y FARMACODINAMIA |
Farmacodinamia: La farmacodinamia del peginterferón alfa-2b fue evaluada en voluntarios sanos en un estudio de dosis única y con aumento gradual de la misma. Se registraron cambios en la temperatura oral, en las concentraciones de proteínas efectoras como la neopterina sérica, y en el conteo de células blancas y neutrófilos. Sujetos tratados con peginterferón alfa-2b mostraron elevaciones moderadas, relacionadas con la dosis, de la temperatura corporal y de los niveles de neopterina y reducción en la cuenta de células blancas y neutrófilos.
Farmacocinética: El peginterferón alfa-2b es un derivado del interferón alfa-2b conjugado con polietilenglicol modificado y está compuesto predominantemente de especies monopegiladas. La vida media plasmática del peginterferón alfa-2b es prolongada en comparación con la del interferón alfa-2b. La Cmáx y AUC del peginterferón alfa-2b son proporcionales a la dosis administrada. Después de la administración subcutánea, las concentraciones séricas máximas ocurren entre 15-44 horas posdosis, y son mantenidas por más de 48-72 horas posdosis. El aparente volumen promedio de distribución es de 0.99 l/kg. Con dosis múltiples existe una acumulación inmunorreactiva de los interferones.
La vida media de eliminación promedio del peginterferón alfa-2b es aproximadamente de 40 horas (13.3 horas), con una depuración aparente de 22.0 ml/kg·hora. Los mecanismos involucrados en la depuración de los interferones no están completamente elucidados. Sin embargo, al parecer, la eliminación renal representa una minoría (aproximadamente del 30%) de la depuración aparente del peginterferón alfa-2b.
Función renal: La depuración renal representa el 30% de la depuración total del peginterferón alfa-2b. En un estudio de una sola dosis (1.0 mcg/kg) en pacientes con trastorno de la función renal, la Cmáx, el AUC, y la vida media se incrementaron en relación al grado de afección renal (véase Contraindicaciones y Precauciones generales). Con base en estos datos, no se recomiendan modificaciones de la dosis basados en la depuración de creatinina. Sin embargo, debido a la marcada variabilidad intra-sujetos en la farmacocinética del interferón, se recomienda una vigilancia estrecha durante el tratamiento con PEGTRÓN® (véase Dosis y vía de administración). Los pacientes con disfunción renal grave o depuración de creatinina < 50 ml/min no deben ser tratados con peginterferón alfa-2b (véase Contraindicaciones).
Función hepática: La farmacocinética de no ha sido evaluada en pacientes con disfunción hepática severa. Por lo tanto, no debe utilizarse PEGTRÓN® en estos pacientes, (véase Contraindicaciones y Precauciones generales).
Paciente ³ 65 años: Parece no haber un efecto significativo relacionado con la edad en la farmacocinética de PEGTRÓN®. Sin embargo, como en los pacientes más jóvenes, la función renal debe ser determinada previamente.
Pacientes < 18 años: No se han realizado evaluaciones específicas de la farmacocinética en estos pacientes. PEGTRÓN® está indicado en el tratamiento de la hepatitis C crónica, solamente en pacientes mayores de 18 años.
Factores neutralizantes de interferón: Los ensayos de factores neutralizantes de interferón fueron realizados en muestras séricas de pacientes que recibieron PEGTRÓN® en los estudios clínicos. Los factores neutralizantes son anticuerpos que neutralizan la actividad antiviral del interferón. La incidencia clínica de factores neutralizantes en pacientes que reciben PEGTRÓN® a la dosis de 0.5 mcg/kg es del 1.1% mientras que a la dosis de 1.5 mcg/kg fue de 2-3%.
Acción: Estudios in vitro e in vivo sugieren que la actividad biológica del peginterferón alfa-2b está producida por la porción de interferón alfa-2b.
Los interferones ejercen sus efectos sobre las células uniéndose a receptores específicos de la membrana plasmática. Estudios con otro interferón han demostrado tener especificidad de especie. Sin embargo, algunas especies de monos, por ejemplo, monos Rhesus, son susceptibles de estimulación farmacodinámica al exponerse a interferón en humanos tipo 1.
Una vez que el interferón se ha unido a la membrana plasmática, inicia una secuencia compleja de eventos intracelulares, que incluyen la inducción de ciertas enzimas. Se piensa que este proceso es responsable, al menos en parte, de las diversas respuestas celulares al interferón, incluyendo la inhibición de la replicación viral en células infectadas con el virus, supresión de la proliferación celular y en actividades inmunomoduladoras como el incremento en la actividad fagocítica de los macrófagos y el aumento en la citotoxicidad específica de los linfocitos a las células blanco. Alguna o todas estas actividades pueden contribuir a los efectos terapéuticos del interferón.
El interferón alfa-2b recombinante también inhibe la replicación viral in vivo e in vitro. Aunque el mecanismo de acción antiviral exacto del interferón alfa-2b recombinante es desconocido, aparentemente altera el metabolismo de la célula huésped. Esta acción inhibe la replicación viral o si existe replicación, los viriones descendientes son incapaces de abandonar la célula. |
| CONTRAINDICACIONES |
El uso de PEGTRÓN ® está contraindicado en pacientes con: Historia de hipersensibilidad al interferón alfa-2b o a cualquiera de los componentes de la fórmula.
Hipersensibilidad a cualquier interferón.
Hepatitis autoinmune o antecedente de enfermedad autoinmune.
Embarazo. No se debe iniciar tratamiento con PEGTRÓN® terapia combinada hasta obtener una prueba de embarazo negativa justo antes de iniciar el tratamiento.
Hombres cuyas parejas estén embarazadas; no pueden ser tratadas con interferón alfa-2b cuando se usa en terapia combinada con ribavirina.
Enfermedad hepática descompensada o disfunción renal severa (depuración de creatinina < 50 ml/min). |
| PRECAUCIONES GENERALES |
Cardiovascular: Como con el interferón alfa-2b, los pacientes con antecedentes de insuficiencia cardiaca congestiva, infarto del miocardio y/o arritmias previas o actuales; y que requieran tratamiento con PEGTRÓN®, deben ser vigilados estrechamente. En aquellos pacientes con anormalidades cardiacas preexistentes se les debe practicar electrocardiograma antes y durante el tratamiento. Las arritmias, principalmente las supraventriculares, generalmente responden a la terapia convencional, pero puede ser necesaria la suspensión de PEGTRÓN®.
Hipersensibilidad aguda: En raras ocasiones se han observado reacciones graves de hipersensibilidad aguda (urticaria, angioedema, broncoconstricción y anafilaxia) durante el tratamiento con interferón alfa-2b. Si ocurriese alguna de estas reacciones, el medicamento deberá suspenderse e instituirse inmediatamente el tratamiento médico adecuado. Los exantemas transitorios no requieren de la interrupción del tratamiento.
Función hepática: Se debe interrumpir el tratamiento con PEGTRÓN® en los pacientes con signos de enfermedad hepática descompensada.
Función renal: Los pacientes con disminución de la función renal deben ser monitorizados estrechamente respecto a signos y síntomas de toxicidad. PEGTRÓN® no debe ser utilizado por pacientes con insuficiencia renal crónica o disminución de la depuración de creatinina < 50 ml/min (véase Contraindicaciones).
Hidratación: Se recomienda mantener una hidratación adecuada en pacientes bajo tratamiento con PEGTRÓN® en terapia combinada debido a que se ha reportado hipotensión relacionada a depleción de líquidos en pacientes tratados con interferón alfa. Puede ser necesario el reemplazo de líquidos.
Fiebre: La fiebre se asocia al síndrome tipo influenza que se ha reportado en los pacientes en tratamiento con interferón; sin embargo, se recomienda descartar otras causas de fiebre.
Cambios oculares: Muy rara vez se han descrito hemorragias retinianas, exudados algodonosos y obstrucción venosa o arterial retiniana en algunos pacientes tratados con interferón alfa. (Véase Reacciones secundarias y adversas). Cualquier paciente que esté en tratamiento con PEGTRÓN® y que refiera cambios en la agudeza o en los campos visuales, o que informe algún otro síntoma oftalmológico, debe ser examinado por el especialista. Se recomienda un examen ocular basal completo antes de iniciar el tratamiento con PEGTRÓN®, y periódicamente durante el mismo ya que las alteraciones informadas deben diferenciarse de las que se observan en enfermedades concomitantes como en la retinopatía diabética o hipertensiva. Se debe considerar discontinuar el tratamiento con PEGTRON® en aquellos pacientes que desarrollen un nuevo o empeore su desorden oftalmológico.
Sistema nervioso central: En algunos pacientes tratados con PEGTRÓN® se han observado efectos neurológicos severos como depresión, ideas suicidas, intento suicida y suicidio. Otros efectos neurológicos incluyendo agresividad, confusión y alteraciones del estado mental han sido reportados con el uso de interferón alfa. Insensibilidad y coma, incluyendo casos de encefalopatía, la mayoría a dosis altas de interferon alfa-2b y en los ancianos, han sido observados en algunos pacientes. Por lo general, estos efectos son reversibles, en algunos pacientes, la resolución completa se ha observado hasta en tres semanas. Muy raramente, han ocurrido convulsiones con altas dosis de interferon alfa-2b. Si el paciente desarrolla trastornos neurológicos o psiquiátricos, incluyendo depresión clínica, se recomienda vigilancia estrecha debido a la seriedad potencial de este evento adverso indeseable. Si persiste la sintomatología o empeora, se debe interrumpir el tratamiento con PEGTRÓN®.
Cambios pulmonares: Infiltrados pulmonares, neumonitis y neumonía, ocasionalmente fatal, han sido observados en pacientes tratados con interferón alfa. A cualquier paciente que desarrolle fiebre, tos, disnea o algún otro síntoma respiratorio debe tomarse una radiografía de tórax. Si la telerradiografía de tórax muestra infiltrados pulmonares o existe deterioro de la función respiratoria, el paciente debe ser vigilado estrechamente. Si resulta apropiado, se suspenderá el tratamiento con PEGTRÓN® Pluma monodosis precargada o PEGTRÓN®. La descontinuación del tratamiento y la administración de corticosteroides parecen estar asociado con resolución de los efectos adversos pulmonares.
Autoinmunidad: Se ha reportado el desarrollo de autoanticuerpos durante el tratamiento con interferón alfa. Las manifestaciones clínicas de enfermedad autoinmune durante el tratamiento con PEGTRÓN® pueden ocurrir más frecuentemente en pacientes con predisposición a desarrollar enfermedades autoinmunes.
Cambios tiroideos: Es infrecuente que pacientes con hepatitis C crónica tratados con interferón alfa desarrollen alteraciones tiroideas, tanto hipertiroidismo como hipotiroidismo. Se deben determinar niveles de hormona estimuladora de la tiroides (TSH) si durante el tratamiento desarrollan síntomas asociados con disfunción tiroidea. En presencia de disfunción tiroidea, el tratamiento con PEGTRÓN® puede continuarse si los niveles de TSH pueden ser mantenidos dentro de límites normales con medicamento.
Otros: Se ha descrito exacerbación de psoriasis, por lo que PEGTRÓN® puede utilizarse en pacientes con psoriasis únicamente si los posibles beneficios justifican los riesgos potenciales.
Pruebas de laboratorio: Se recomienda valoración de pruebas hematológicas, química sanguínea y pruebas de función tiroidea antes y periódicamente durante el tratamiento con PEGTRÓN®. Los valores basales aceptables considerados como guía de tratamiento son:
Plaquetas ³ 100,000/mm3
Neutrófilos ³ 1,500/mm3
Hormona estimulante de la tiroides (TSH) en límites normales. Las pruebas de laboratorio deberán realizarse en las semanas 2 y 4 del tratamiento y periódicamente conforme sea clínicamente apropiado.
Alteraciones metabólicas: Hipertrigliceridemia y/o exacerbación de la hipertrigliceridemia, se recomienda vigilar los niveles de lípidos en los pacientes bajo tratamiento.
Trasplante: La seguridad y eficacia de PEGTRÓN® solo o en combinación con ribavirina para el tratamiento de la hepatitis C en receptores de hígado o algún otro órgano trasplantado, no han sido estudiadas. Datos preliminares indican que la terapia con interferón alfa puede asociarse con un aumento en la tasa de rechazos de riñón. Rechazos hepáticos también han sido reportados, pero no se ha establecido una asociación causal con la terapia de interferón alfa.
Precauciones para operar maquinaria y habilidad para conducir vehículos: Los pacientes pueden desarrollar fatiga, somnolencia y/o confusión durante el tratamiento con PEGTRÓN®, por lo que deben tomarse las precauciones necesarias durante su uso. |
| RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA |
El interferón alfa ha mostrado ser abortivo en primates. PEGTRÓN ® es posible que cause también este efecto. Debido a que no existen estudios en mujeres embarazadas, no se recomienda el uso de PEGTRÓN® durante el embarazo.
Por lo tanto, se recomienda un adecuado control anticonceptivo en mujeres en edad fértil que reciben tratamiento con PEGTRÓN®.
Embarazo: La terapia combinada no debe ser utilizada durante el embarazo, dado que la ribavirina ha mostrado un efecto teratogénico y embricida en todas las especies probadas, incluso a dosis hasta 20 veces menores de las recomendadas para uso humano, el efecto teratogénico se incrementa con el aumento en la dosis empleada de ribavirina. La sobrevida de fetos y productos es reducida, por lo que no se recomienda iniciar la terapia combinada sin una prueba de embarazo negativa y durante el tratamiento, realizarla mensualmente; si el embarazo ocurriera durante el tratamiento o en los siguientes 6 meses de suspendido éste, la paciente debe ser alertada del potencial teratogénico de la ribavirina.
Las parejas femeninas de pacientes hombres bajo tratamiento con PEGTRÓN® deben extremar precauciones para evitar el embarazo mientras los pacientes hombres estén recibiendo ribavirina y deben por tanto, ser asesorados sobre el uso de anticonceptivos efectivos durante el tratamiento con PEGTRÓN® y seis meses después de concluido éste.
La ribavirina se acumula intracelularmente y se excreta muy lentamente del organismo, en estudios animales, la ribavirina produce cambios en los espermas a dosis menores de las utilizadas clínicamente. Se desconoce si la ribavirina contenida en el esperma ejercerá su efecto teratogénico posterior a la fecundación del óvulo.
Lactancia: Se desconoce si los componentes de la terapia combinada se excretan en la leche materna. Debido al riesgo potencial de producir reacciones adversas en los productos, la recomendación es descontinuar la lactancia antes del inicio del tratamiento con terapia combinada. |
| REACCIONES SECUNDARIAS Y ADVERSAS |
PEGTRÓN® en monoterapia: Los efectos indeseables fueron en severidad de leves a moderados y no limitaron el tratamiento. La mayoría de los pacientes reportaron cefalea y mialgia.
Efectos reportados muy comúnmente (³ 10% de los pacientes) fueron: inflamación y dolor en el sitio de la inyección, fatiga, temblores, fiebre, depresión, artralgia, náusea, alopecia, dolor musculosquelético, irritabilidad, síntomas semejantes a la influenza, insomnio, diarrea, dolor abdominal, astenia, faringitis, disminución de peso, anorexia, ansiedad, dificultad en la concentración, mareos y reacción en el sitio de aplicación.
Efectos reportados comúnmente (³ 2% de los pacientes) fueron: prurito, piel seca, malestar, incremento en la sudación, dolor en el cuadrante superior derecho, neutropenia, leucopenia, anemia, rash, vómito, boca seca, labilidad emocional, nerviosismo, disnea, infección viral, somnolencia, trastornos tiroideos, dolor torácico, dispepsia, rubores, parestesias, tos, agitación, sinusitis, hipertonía, hiperestesia, visión borrosa, confusión, flatulencia, disminución en la libido, eritema, dolor ocular, apatía, hipoestesia, disminución en la consistencia de las heces, conjuntivitis, congestión nasal, constipación, vértigo, menorragia, trastornos menstruales.
En pacientes tratados con PEGTRÓN® durante los estudios clínicos, los eventos psiquiátricos fueron poco comunes; los eventos psiquiátricos que ponen en riesgo la vida fueron infrecuentes.
Estos eventos incluyeron, suicidio, ideación suicida, intento suicida y psicosis, incluyendo alucinaciones.
Granulocitopenia (< 0.75 x 109/l) ocurrió en 4 y 7% y trombocitopenia (< 70 x 109/l) en el 1 y 3% respectivamente, en pacientes que recibieron 0.5 ó 1.0 mcg/kg de PEGTRÓN®.
PEGTRÓN® en terapia combinada con ribavirina se han reportado los siguientes efectos adversos:
Reportados entre 5 y 10%: Taquicardia, rinitis, enrarecimiento del sabor.
Efectos adversos reportados entre 2 y 5%: Hipotensión, trastorno de la glándula lagrimal, hipertensión, síncope, temblor, sangrado en encías, glositis, estomatitis, estomatitis ulcerativa, disminución o trastorno de la audición, tinnitus, palpitaciones, sed, conducta agresiva, infección por hongos, prostatitis, otitis media, bronquitis, trastorno respiratorio, rinorrea, eccema, textura anormal del cabello, reacción de fotosensibilidad y linfadenopatía.
Raramente se han reportado eventos adversos con interferón alfa-2b: crisis convulsivas, pancreatitis, hipertrigliceridemia, arritmia, diabetes y neuropatía periférica.
Muy raramente la terapia combinada de PEGTRÓN® con ribavirina puede estar asociada con anemia aplásica.
Otros eventos adversos que pueden ocurrir con PEGTRÓN® en monoterapia o en combinación con ribavirina son:
Ocasionalmente han sido reportadas alteraciones oftalmológicas que incluyen retinopatía (incluyendo edema macular), hemorragia retiniana, obstrucción de vena o arteria retiniana, exudados algodonosos, pérdida de agudeza visual o del campo visual, neuritis óptica y papiledema (véase Precauciones generales).
Los eventos adversos cardiovasculares (CVS), particularmente la arritmia, la mayoría están correlacionados con una cardiopatía preexistente y previamente tratados con agentes cardiotóxicos. Raramente se ha reportado cardiomiopatía reversible después de discontinuar el interferón alfa en pacientes sin evidencia de cardiopatía previa. Posterior a la comercialización de PEGTRÓN® se han reportado raramente rabdomiolisis, miositis, insuficiencia renal y falla renal.
Muy raramente, isquemia cardiaca, infarto al miocardio, isquemia cerebrovascular, hemorragia cerebrovascular, encefalopatía (véase Precauciones generales), colitis ulcerativa e isquémica, exacerbación de sarcoidosis o sarcoidosis, eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica y necrosis en el sitio de inyección. |
| INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO |
En los estudios de dosis múltiples no se observaron interacciones farmacocinéticas entre peginterferón alfa-2b y ribavirina. Los resultados de los estudios de interacciones farmacocinéticas con una sola dosis de PEGTRÓN ® demostraron no tener efecto en la actividad del citocromo P-450 (CYP) 1A 2, CYP2C8/9, CYP2D6 y CYP3A4 o N-acetil transferasa hepática. Sin embargo, en la literatura se reporta hasta 50% de reducción en la depuración de sustratos de CYP1A2 (ejemplo, teofilina) cuando se administran con otras formas de interferón alfa y, por lo tanto, se recomienda precaución cuando PEGTRÓN® se administre con medicamentos metabolizados por CYP 1A2.
Un estudio de dosis múltiples, de análisis de sustratos del P-450, fue realizado en 26 sujetos con hepatitis C crónica, quienes recibieron peginterferón alfa-2b (1.5 mcg/kg) a la semana, durante 4 semanas. No se encontraron inhibiciones de CYP1A2, 3A4 o de la N-acetiltransferasa. Hubo un incremento del 27% en la actividad de CYP2C8/9 y del 69% en CYP2D6.
Se deben tomar precauciones cuando se administre interferón alfa-2b junto con medicamentos metabolizados por CYP2C8/9 y CYP2D6.
Los pacientes co-infectados con el Virus de Inmunodeficiencia Humana (VIH) y que están recibiendo Tratamiento Anti-Retroviral Altamente Activo (HAART) pueden tener un riesgo elevado de desarrollar acidosis láctica. Se debe tener precaución cuando se adicione PEGTRÓN® más ribavirina al HAART. |
| ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO |
Los cambios de laboratorio reportados (hemoglobina, leucocitos, neutrófilos y plaquetas) asociados a PEGTRÓN ® han sido de leves a moderados en severidad. Los casos reportados de neutropenia, leucopenia, granulocitopenia y trombocitopenia respondieron a la modificación de la dosis.
Ningún paciente experimentó trombocitopenia grado 4 (< 25,000 x 109/l) o neutropenia < 0.5 x 109/l; 3% de los pacientes tratados con PEGTRÓN® tuvieron trombocitopenia grado 3 (plaquetas entre 25,000 y 50,000 x 109/l), mientras que 9% de los que recibieron tratamiento con PEGTRÓN® tuvieron neutropenia grado 3 (0.25 a < 0.50 x 109/l).
Favor de referirse a la información de la ribavirina en el caso de la terapia combinada para ampliar la información de los efectos secundarios relacionados. |
| PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD |
No se han realizado estudios de reproducción con PEGTRÓN ®. El interferón alfa-2b ha mostrado ser abortivo en primates. Es posible que PEGTRÓN® pueda tener este efecto. Los efectos sobre la fertilidad no han sido determinados. PEGTRÓN® no ha demostrado potencial genotóxico.
La relativa ausencia de toxicidad del monometoxi polietilenglicol (mPEG) que es liberado del metabolismo in vivo del peginterferón alfa-2b ha sido demostrada en estudios preclínicos de toxicidad aguda y subcrónica en roedores y monos, y estudios de desarrollo embrio-fetal y por estudios de mutagenicidad in vitro. |
| DOSIS Y VÍA DE ADMINISTRACIÓN |
Monoterapia con PEGTRÓN®: Se administra vía subcutánea a una dosis de 0.5 ó 1.0 mcg/kg una vez por semana al menos durante 6 meses.
La dosis debe seleccionarse con base en la eficacia e innocuidad previstas. En pacientes que presentan RNA del VHC negativo a los 6 meses, el tratamiento debe continuarse por otros 6 meses más, es decir, un año de tratamiento.
Cuando se recomienda la auto-administración, se debe aconsejar al paciente que cambie el sitio de la inyección cada vez que la administre. El tratamiento con PEGTRÓN® debe suspenderse en pacientes que no muestren pérdida del RNA del VHC a los 6 meses.
Si durante la administración de PEGTRÓN® se presentan efectos adversos, la dosis puede modificarse (reducción de 50%) hasta la desaparición de los mismos. Si es persistente o recurre después de ajustar la dosis, debe suspenderse la administración de PEGTRÓN®.
Se recomienda disminuir la dosis si el conteo de neutrófilos es < 0.75 x 109/l o si el conteo de plaquetas es < 50,000 x 109/l. Se debe suspender el tratamiento si el conteo de neutrófilos es < 0.50 x 109/l o si las plaquetas son menores de 25,000 x 109/l.
Enfermedad renal: La depuración de PEGTRÓN® está disminuida en pacientes con enfermedad renal significativa (depuración de creatinina £ 50 ml/min).
Se recomienda vigilancia estrecha y disminución de la dosis a juicio del médico.
Enfermedad hepática: La seguridad y eficacia de PEGTRÓN® no han sido evaluadas en pacientes con enfermedad hepática grave, por lo tanto, no se recomienda su uso.
Uso en ancianos (³ 65 años): No existen efectos aparentes sobre la farmacocinética de PEGTRÓN® relacionados con la edad. Datos de pacientes ancianos tratados con una sola dosis de PEGTRÓN® sugieren que no se requieren ajustes de la dosis basados en la edad.
Uso en menores de 18 años: PEGTRÓN® no se recomienda para uso en niños o adolescentes menores de 18 años, no existe experiencia en este grupo de edad.
Terapia combinada PEGTRÓN® con ribavirina: Se recomienda utilizar peginterferón alfa-2b a dosis de 1.5 mcg/kg/semana subcutáneo en combinación con ribavirina cápsulas (véase tabla 3). El peginterferón alfa-2b deberá administrarse una vez a la semana.
La dosis de ribavirina a utilizar en combinación con peginterferón alfa-2b se basa en el peso corporal del paciente (tabla 3). Las cápsulas de ribavirina deben ser administradas vía oral diariamente en dos dosis divididas con los alimentos (mañana y noche).
Como una alternativa para el cálculo de la dosificación, se ha desarrollado para el uso de PEGTRÓN® un sistema simplificado, basado en la experiencia con estudios clínicos (tabla 4). Esta tabla coordina la dosificación de PEGTRÓN® por grupos según el peso corporal y la simplifica a la dosis más apropiada. También se integra este sistema para la ribavirina.
Duración del tratamiento: Con base en resultados de estudios clínicos, se recomienda que los pacientes sean tratados al menos durante 6 meses. En estudios clínicos en que los pacientes fueron tratados durante un año, aquellos pacientes con falta de respuesta viral después de 6 meses de tratamiento (RNA-VHC debajo del límite inferior de detección), fue improbable que se convirtieran en respondedores virales sostenidos (RNA-VHC debajo del límite inferior de detección 6 meses después de suspender el tratamiento).
Genotipo 1: El tratamiento debe continuarse por otros seis meses (en total un año) en pacientes que negativizaron RNA-VHC, después de seis meses de tratamiento.
Genotipos no-1: La decisión de extender el tratamiento a un año en pacientes que negativizaron RNA-VIC, después de seis meses de tratamiento debe estar basado en otros factores pronósticos (por ejemplo edad > 40 años, género masculino, bandas fibrosas).
Para los pacientes que mostraron respuesta viral a la semana 12, se debe continuar el tratamiento por otros 9 meses (en total de 1 año de tratamiento).
Modificación de la dosis para todos los pacientes: Si se desarrollan eventos adversos o anormalidades de laboratorio durante el tratamiento con PEGTRÓN® terapia combinada es apropiado modificar la dosis de cada producto, hasta que se resuelva la reacción adversa. Las guías para modificación de la dosis fueron desarrolladas en estudios clínicos (véase Guía para la modificación en la tabla 4).
* Pacientes con reducción de la dosis de ribavirina a 600 mg diarios (1 cápsula de 200 mg en la mañana y 2 cápsulas de 200 mg en la noche).
** Por arriba del límite normal.
Preparación y administración: PEGTRÓN® no debe mezclarse con otros productos inyectables. PEGTRÓN® está disponible en dosis de 50, 80, 100, 120, y 150 mcg. Cada frasco ámpula debe ser reconstituido con 0.7 ml de agua inyectable esterilizada para administración de hasta 0.5 ml de solución. Una vez reconstituida la solución ofrece 100, 160, 200, 240 y 300 mcg por mililitro, respectivamente.
Los medicamentos que se administran vía parenteral deben ser inspeccionados en busca de precipitados y cambios de coloración antes de ser administrados.
Utilice una jeringa y aguja esterilizadas, inyecte 0.7 ml de agua estéril para inyección dentro del ámpula de PEGTRÓN®. Mezcle lentamente hasta completar la disolución del polvo. La dosis apropiada puede ser cargada y aplicada.
La pluma monodosis precargada de PEGTRÓN® provee en 0.5 ml de solución de PEGTRÓN® 50, 80, 100, 120 y 150 mcg lista para aplicarse, ya sea como monoterapia o como terapia combinada.
El polvo liofilizado y el solvente (agua estéril para inyectar) están contenidos en un cartucho dual para una sola aplicación una vez reconstituido. La pluma monodosis precargada de PEGTRÓN® se utiliza para aplicación subcutánea, la aguja necesaria para la aplicación viene incluida en el set de aplicación de la dosis prescrita (véase Instructivo para el paciente en el inserto).
Saque del refrigerador la pluma monodosis precargada de PEGTRÓN®, y permita que alcance la temperatura ambiente antes de la aplicación.
Después de reconstituir con agua inyectable estéril, la solución de PEGTRÓN® es estable por 24 horas entre 2-8°C. Una vez preparada la solución debe ser utilizada inmediatamente. Se puede mantener en refrigeración por 24 horas entre 2 y 8°C. |
| MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL |
En estudios clínicos se han reportado casos de sobredosis accidental, nunca más del doble de la dosis indicada. No se reportaron reacciones graves. Los efectos indeseables se resolvieron al descontinuar la administración de PEGTRÓN®. |
| PRESENTACIONES |
PEGTRÓN ® se presenta en caja con frasco ámpula con 50, 80, 100, 120, y 150 mcg de peginterferón alfa-2b y ampolleta con 0.7 ml de agua inyectable como diluyente.
Pluma monodosis precargada de PEGTRÓN®, cada pluma provee en 0.5 ml de solución de PEGTRÓN® 50, 80, 100, 120, y 150 mcg, en cada una de sus presentaciones, respectivamente, lista para aplicarse. |
| RECOMENDACIONES SOBRE ALMACENAMIENTO |
Consérvese en refrigeración entre 2 y 8°C. No congelar. |
| LEYENDAS DE PROTECCIÓN |
Su venta requiere receta médica.
Literatura exclusiva para médicos.
No se deje al alcance de los niños.
No se emplee si la sustancia se oscurece o contiene precipitado.
Antes de utilizar el producto léase el instructivo anexo.
PEGTRÓN® deberá ser administrado únicamente por médicos con experiencia en productos de biotecnología.
Si requiere mayor información, solicítela a la Dirección Médica al 5728-4422.
Reg. Núm. 554M2000, SSA IV
KEAR-03361201376/RM2003 |
|
|