|
Diccionario de Especialidades Farmacéuticas.
Definición de Medicinas, Substancias Activas, Presentación e Indicaciones
CO-DIOVAN
En esta página se pueden buscar definiciones de medicamentos, substancias activas, presentaciones, forma farmacéutica y formulación, indicaciones, contraindicaciones, dosis y vía de administración de casi todas las medicinas en venta.
Si desea buscar en el nombre de la medicina, hay que palomear la opción MEDICAMENTO, si quiere también buscar en la SUBSTANCIA ACTIVA o en las INDICACIONES, entonces palomear las opciones deseadas.
Por Ejemplo:
Para buscar los medicamentos INDICADOS para el resfriado o embarazo, se palomea la opción INDICACIONES y se pone en el campo de busqueda la palabra "resfriado" o "embarazo".
Para buscar los medicamentos que tengan como SUBSTANCIA ACTIVA Ibuprofeno o Piroxicam se palomea la opción SUBSTANCIA y se pone en el campo de busqueda la palabra deseada.
No usar acentos.
|
|
A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
|
|
|
| Tip: Si se hace doble-click sobre una palabra, esta automáticamente se copia al campo de búsqueda. |
|
|
NOVARTIS FARMACÉUTICA, S.A. DE C.V. |
Calz. de Tlalpan Núm. 1779, Col. San Diego Churubusco, Deleg.Coyoacán, 04120 México D.F.
Tel.: 5549-3000
|
|


|
CO-DIOVAN
Tabletas recubiertas
HIDROCLOROTIAZIDA
VALSARTÁN
DESCRIPCION:
CO-DIOVAN. Tratamiento de la hipertension. Tabletas recubiertas. NOVARTIS
| FORMA FARMACÉUTICA Y FORMULACIÓN |
Cada TABLETA contiene: Valsartán 80 mg 160 mg 160 mg Hidroclorotiazida 12.5 mg 12.5 mg 25 mg Excipiente, c.b.p. 1 tableta. |
| INDICACIONES TERAPÉUTICAS |
Tratamiento de la hipertensión.
CO-DIOVAN® está indicado en el tratamiento de la hipertensión en pacientes cuya tensión arterial no se controla adecuadamente mediante monoterapia. Este tipo de asociación de dosis fijas debe utilizarse como tratamiento de segunda línea. |
| FARMACOCINÉTICA Y FARMACODINAMIA |
Propiedades farmacocinéticas:
Valsartán: La absorción de valsartán tras su administración oral es rápida, aunque la cantidad absorbida es muy variable. La media de biodisponibilidad absoluta de valsartán es del 23%. El valsartán presenta una cinética de eliminación multiexponencial (t½a< 1 hora y t½ß de aproximadamente 9 horas).
La farmacocinética del valsartán es lineal en el intervalo de dosis probadas. No se aprecian cambios en la cinética de valsartán con la administración repetida, y la acumulación es pequeña cuando se administra una vez por día. Las concentraciones plasmáticas son similares en ambos sexos.
El valsartán se halla extremadamente unido (94-97%) a las proteínas plasmáticas, sobre todo a la albúmina sérica. El volumen de distribución en estado estacionario es reducido (cerca de 17 l).
La depuración plasmática es relativamente lenta (cerca de 2 l/h) en comparación con el flujo sanguíneo hepático (de unos 30 l/h).
De la dosis absorbida de valsartán, el 70% se excreta en las heces y el 30% en la orina, principalmente como compuesto inalterado.
Cuando el valsartán se administra con alimentos, el área bajo la curva (AUC) de concentración plasmática del fármaco disminuye en 48%, aunque a partir de las 8 horas siguientes a la toma las concentraciones plasmáticas de valsartán son similares en los grupos alimentados y en ayunas. Esta reducción de AUC, no obstante, no se acompaña de una reducción clínicamente significativa del efecto terapéutico.
Hidroclorotiazida: La absorción de hidroclorotiazida tras su administración oral es rápida (Tmáx de cerca de 2 horas), con características similares en las formulaciones en suspensión y en comprimidos. La cinética de distribución y eliminación se ha descrito generalmente mediante una función de disminución biexponencial, con una semivida terminal de 6 a 15 horas.
El aumento de la media de AUC es lineal y proporcional a la dosis en el margen terapéutico. Tras tomas repetidas no se producen cambios en la cinética de la hidroclorotiazida y la acumulación es mínima con una toma diaria.
La biodisponibilidad absoluta de la hidroclorotiazida es de 60 a 80% tras la administración oral. Más de 95% de la dosis absorbida se excreta en la orina como compuesto inalterado, y el 4% restante como hidrolizado 2-amino-4-cloro-m-bencendisulfonamida.
La administración simultánea de hidroclorotiazida con alimentos puede incrementar o disminuir su disponibilidad sistémica en comparación con la administración en ayunas. La magnitud de estos efectos es pequeña y de escasa importancia clínica.
Valsartán/hidroclorotiazida: La biodisponibilidad sistémica de la hidroclorotiazida disminuye en cerca de 30% cuando se administra con el valsartán. La coadministración de hidroclorotiazida no afecta pronunciadamente a la cinética de valsartán.
Esta interacción no ejerce ninguna influencia sobre el empleo de la asociación valsartán-hidroclorotiazida, dado que los ensayos clínicos controlados han evidenciado un claro efecto antihipertensor, superior al obtenido con cualquiera de los dos fármacos por separado o con el placebo.
Poblaciones especiales:
Ancianos: En algunos ancianos se observa una exposición sistémica algo mayor que en los individuos jóvenes, pero no se ha demostrado su importancia clínica.
Los escasos datos disponibles indican que la depuración sistémica de la hidroclorotiazida en los individuos de edad avanzada sanos o hipertensos es más reducida que en los voluntarios jóvenes sanos.
Insuficiencia renal: En los pacientes con depuración de creatinina entre 30 y 70 ml/min no se necesitan ajustes de la dosis.
No hay datos sobre los efectos de CO-DIOVAN® en pacientes con deterioro grave de la función renal (depuración de creatinina < 30 ml/min) y en pacientes dializados. El valsartán se une fuertemente a las proteínas plasmáticas y no ha de eliminarse por diálisis, a diferencia de la hidroclorotiazida, que se elimina por diálisis.
La depuración renal de la hidroclorotiazida se hace por filtración pasiva y secreción activa en el túbulo renal. Como cabe esperar de un fármaco que es eliminado casi exclusivamente por vía renal, la función renal ejerce un marcado efecto sobre la cinética de la hidroclorotiazida.
Insuficiencia hepática: En un estudio farmacocinético de pacientes con disfunción hepática leve (n = 6) a moderada (n = 5), la exposición al valsartán aumentó aproximadamente al doble, en comparación con la de voluntarios sanos.
No hay datos sobre el empleo del valsartán en pacientes con disfunción hepática grave. La hepatopatía no afecta de forma significativa la farmacocinética de la hidroclorotiazida y no se considera necesario reducir la dosis.
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Asociaciones de antagonistas de la angiotensina II (valsartán) con diuréticos (hidroclorotiazida); código ATC: C09D A03.
La hormona activa del sistema renina-angiotensina-aldosterona es la angiotensina II, formada a partir de la angiotensina I por acción de la ECA. La angiotensina II se une a receptores específicos localizados en las membranas celulares de diversos tejidos.
Ejerce una amplia variedad de efectos fisiológicos entre los que pueden citarse, en particular, una participación tanto directa como indirecta en la regulación de la tensión arterial.
Como vasoconstrictor potente, la angiotensina II ejerce una acción vasopresora directa. Además, promueve la retención de sodio y estimula la secreción de aldosterona.
El valsartán es un antagonista oralmente activo y específico del receptor de la angiotensina II (Ang II). Actúa preferentemente sobre el subtipo de receptor AT1, el receptor responsable de los efectos consabidos de la angiotensina II. Las concentraciones plasmáticas elevadas de la angiotensina II tras el bloqueo del receptor AT1 con valsartán puede estimular el receptor AT2 no bloqueado, lo que aparentemente contrarresta el efecto del receptor AT1. El valsartán no muestra actividad agonista parcial alguna en el receptor AT1 y tiene una afinidad mucho mayor (aproximadamente 20,000 veces mayor) por ese receptor que por el AT2.
El valsartán no inhibe la ECA, conocida también como cininasa II, que convierte la angiotensina I en angiotensina II y degrada la bradicinina. No es de esperar potenciación de los efectos colaterales relacionados con la bradicinina. En los ensayos clínicos en los que se comparó valsartán con un inhibidor de la ECA, la incidencia de tos seca fue significativamente menor (P < 0.05) en los pacientes tratados con valsartán que en los que recibieron el inhibidor de la ECA (2.6% frente a 7.9%, respectivamente). En un ensayo clínico en el que participaron pacientes con antecedentes de tos seca durante el tratamiento con inhibidores de la ECA, sólo sufrió tos 19.5% de los individuos tratados con valsartán y 19.0% de los tratados con diuréticos tiazídicos, en comparación con 68.5% de los tratados con un inhibidor de la ECA (P < 0.05). El valsartán no se une ni bloquea otros receptores de hormonas o canales iónicos conocidos por su importancia en la regulación cardiovascular.
La administración de valsartán en pacientes con hipertensión reduce la tensión arterial sin afectar a la frecuencia cardiaca.
En la mayoría de los pacientes, tras la administración de una dosis oral única, la actividad antihipertensora comienza a manifestarse en un plazo de 2 horas, lográndose la máxima reducción de la tensión arterial en 4-6 horas. El efecto antihipertensor persiste más de 24 horas tras la administración.
En tomas repetidas, la máxima reducción de la tensión arterial con una dosis cualquiera se alcanza generalmente en 2-4 semanas y es sostenida durante un tratamiento a largo plazo.
La asociación con hidroclorotiazida proporciona una reducción adicional y significativa de la tensión arterial.
El principal lugar de actuación de los diuréticos tiazídicos es el túbulo contorneado distal. Se ha demostrado que hay un receptor de alta afinidad en la corteza renal y que el principal sitio de unión para la acción diurética de las tiazidas y la inhibición del transporte de NaCl está situado en el túbulo contorneado distal.
El modo de acción de las tiazidas consiste en la inhibición del simportador de Na + Cl-, quizá por competencia con el sitio del Cl-afectando a los mecanismos de reabsorción de electrólitos: directamente, incrementando la excreción de sodio y cloro en cantidades aproximadamente equivalentes, e indirectamente por la acción diurética, que reduce el volumen plasmático, con el consiguiente incremento de la actividad de la renina plasmática, de la secreción de aldosterona y de la pérdida urinaria de potasio, así como disminuciones del potasio sérico.
Como la angiotensina II media de vínculo entre la renina y la aldosterona, la administración simultánea de antagonistas del receptor de angiotensina II tiende a revertir la pérdida de potasio asociada a estos diuréticos. |
| CONTRAINDICACIONES |
Hipersensibilidad a valsartán o hidroclorotiazida o a cualquiera de los excipientes de CO-DIOVAN®. Embarazo. Deterioro grave de la función hepática, cirrosis biliar y colestasis. Anuria y deterioro grave de la función renal (depuración de creatinina < 30 ml/min).
Hipocaliemia refractaria, hiponatremia, hipercalcemia e hiperuricemia sintomática. |
| PRECAUCIONES GENERALES |
Alteraciones de los electrólitos séricos: El empleo simultáneo de suplementos de potasio, diuréticos ahorradores de potasio, sustitutos de la sal que contienen potasio u otros fármacos que puedan incrementar las concentraciones de potasio (heparina, etc.) debe hacerse con cautela.
Se han descrito casos de hipocaliemia durante el tratamiento con diuréticos tiazídicos. Se recomiendan controles frecuentes del potasio sérico.
El tratamiento con diuréticos tiazídicos se ha asociado a hiponatremia y alcalosis hipoclorémica. Las tiazidas incrementan la excreción urinaria de magnesio y pueden producir hipomagnesemia
Pacientes hipovolémicos o hiponatriémicos: En pacientes con disminución grave de sodio o de volumen, como los tratados con altas dosis de diuréticos, se puede producir, aunque raramente, hipotensión sintomática tras el inicio del tratamiento con CO-DIOVAN®. La disminución de sodio o de volumen debe ser corregida antes de iniciar el tratamiento con CO-DIOVAN®.
En caso de hipotensión, se colocará al paciente en decúbito y se administrará, si fuera necesario, una infusión intravenosa de solución fisiológica. Una vez que la tensión arterial haya sido estabilizada, se puede proseguir con el tratamiento.
Estenosis de la arteria renal: No se ha establecido la seguridad de CO-DIOVAN® en pacientes con estenosis unilateral o bilateral de la arteria renal o estenosis arterial en individuos con un solo riñón.
Insuficiencia renal: No se necesitan ajustes de la dosis en pacientes con deterioro de la función renal (depuración de creatinina > 30 ml/min).
Insuficiencia hepática: En los pacientes con insuficiencia hepática leve a moderada sin colestasis, no se precisan ajustes posológicos. No obstante, CO-DIOVAN® debe utilizarse con cautela. La hepatopatía no altera significativamente la farmacocinética de la hidroclorotiazida.
Lupus eritematoso sistémico: Los diuréticos tiazídicos pueden exacerbar o activar el lupus eritematoso sistémico.
Otros trastornos metabólicos: Los diuréticos tiazídicos pueden alterar la tolerancia a la glucosa e incrementar las concentraciones séricas de colesterol, triglicéridos y ácido úrico. |
| RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA |
Debido al mecanismo de acción de los antagonistas de la angiotensina II, no se pueden descartar los riesgos para el feto. Se han descrito casos de lesión y muerte fetal tras la exposición in utero a los inhibidores de la ECA administrados durante el segundo y tercer trimestre del embarazo. La exposición intrauterina a los diuréticos tiazídicos se asocia a trombocitopenia fetal o neonatal y se puede asociar a otras reacciones adversas descritas en adultos. Han habido reportes de aborto espontáneo, oligohidramnios y disfunción renal en recién nacidos, cuando la mujer embarazada ha tomado inadvertidamente valsartán. Como cualquier otro fármaco que actúe directamente sobre el sistema renina-angiotensina-aldosterona, CO-DIOVAN® no se debe utilizar durante el embarazo ni la lactancia.
Si el embarazo se declara durante el tratamiento, la administración de CO-DIOVAN® se interrumpirá lo antes posible.
No se sabe si el valsartán se excreta en la leche humana. Valsartán se excreta en la leche de ratas lactantes.
La hidroclorotiazida cruza la placenta y se excreta en la leche humana. Por consiguiente, no es recomendable administrar CO-DIOVAN® a mujeres que estén dando el pecho. |
| REACCIONES SECUNDARIAS Y ADVERSAS |
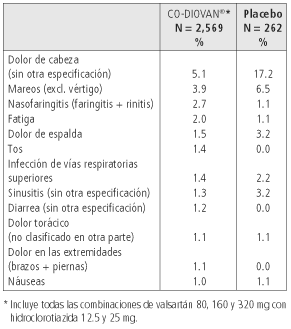
La seguridad de CO-DIOVAN® ha sido evaluada en más de 2,831 pacientes. Los acontecimientos adversos han sido generalmente leves y transitorios.
El cuadro siguiente de reacciones adversas se basa en tres ensayos controlados en los que participaron 2,831 pacientes en total.
De los 2,831 pacientes, 2,569 recibieron valsartán en combinación con hidroclorotiazida. La incidencia global de acontecimientos adversos con CO-DIOVAN® fue similar a la registrada con placebo.
En la tabla se incluyen todos los acontecimientos adversos con una incidencia igual o superior a 1%, independientemente de su relación causal con el fármaco de estudio.
Otros acontecimientos adversos con una frecuencia inferior a 1% son: abdominalgia, dolor abdominal superior, visión anómala, ansiedad, artralgia, artritis, bronquitis, bronquitis aguda, dolor en el pecho, vértigo, dispepsia, disnea, boca seca, impotencia, gastroenteritis, hipersensibilidad, hiperhidrosis, hipoestesia, hipocaliemia, hipotensión, influenza, insomnio, calambre en las piernas, frecuencia miccional, calambres en el músculo, distensión del músculo, mialgia, congestión nasal, dolor de cuello, edema periférico, otitis media, dolor en extremidades, palpitaciones, parestesia, pirexia, congestión de seno nasal, somnolencia, erupción cutánea, esguinces y distensiones musculares, taquicardia, tinnitus, infección de vías urinarias, infección vírica, edema, astenia, visión borrosa, vértigo.
No se sabe si estos sucesos guardaban una relación causal con el tratamiento. Los datos poscomercialización han revelado casos sumamente inusuales de angioedema, erupción cutánea, prurito y otras reacciones de hipersensibilidad/alérgicas, incluidas la enfermedad del suero y la vasculitis. También se han registrado casos muy esporádicos de función renal deficiente y mialgia. Han sido reportados múltiples casos de edema pulmonar inducido por la hidroclorotiazida con infiltración de granulocitos y depósitos de IgG en las membranas alveolares. El edema pulmonar no cardiogénico puede ser una rara reacción idiosincrática a la hidroclorotiazida mediada inmunológicamente.
Hallazgos de laboratorio: Un descenso mayor de 20% en el potasio sérico fue observado en el 2.2% de pacientes que recibieron Co-Diovan® en comparación a placebo (3.3%).
Ocurrieron elevaciones en la creatinina y nitrógeno de urea séricos en 2 y 13%, respectivamente en pacientes que tomaron Co-Diovan® y en 0.4 y 6%, respectivamente de los pacientes que tomaron placebo en estudios clínicos controlados.
Se ha observado neutropenia en 0.1% de pacientes tratados con Co-Diovan® versus 0.4% de los pacientes tratados con placebo.
Valsartán: Otros acontecimientos adversos descritos en los ensayos clínicos de monoterapia con valsartán han sido, independientemente de su asociación causal con el fármaco de estudio, los siguientes:
Con frecuencia superior al 1%: Artralgia.
Con una frecuencia inferior al 1%: Edema, astenia, insomnio, erupción cutánea, disminución de la libido y vértigo.
Hidroclorotiazida: La hidroclorotiazida ha sido prescrita considerablemente, con frecuencia en dosis superiores a las contenidas en CO-DIOVAN®, y durante muchos años. En pacientes tratados únicamente con diuréticos tiazídicos, incluida la hidroclorotiazida, se han descrito las siguientes reacciones adversas:
Trastornos electrolíticos y metabólicos: Véase Precauciones generales.
Otras: Frecuentes: urticaria y otras erupciones cutáneas, pérdida de apetito, náusea ligera y vómitos, hipotensión postural, que puede ser agravada por el alcohol, los anestésicos o los sedantes e impotencia. Raras: fotosensibilización, dolor abdominal, obstipación, diarrea, molestias gastrointestinales, colestasis intrahepática o ictericia, arritmias cardiacas, cefaleas, mareos o desorientación, trastornos del sueño, depresión, parestesias, trastornos de la vista y trombocitopenia, a veces con púrpura. Muy raras: vasculitis necrosante y necrólisis epidérmica tóxica, reacciones similares al lupus eritematoso cutáneo, reactivación del lupus eritematoso cutáneo, pancreatitis, leucopenia, agranulocitosis, mielodepresión, anemia hemolítica, reacciones de hipersensibilidad y disnea, incluidos la neumonitis y el edema pulmonar. |
| INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO |
El empleo simultáneo de otros fármacos antihipertensores puede potenciar el efecto antihipertensor. Los suplementos de potasio, los diuréticos ahorradores de potasio, los sustitutos de la sal que contienen potasio y otros fármacos que puedan alterar las concentraciones de potasio (heparina, etc.) deben ser utilizados con cautela y con frecuentes controles de potasio.
Durante el tratamiento simultáneo con inhibidores de la enzima de conversión de la angiotensina (ECA) y tiazidas, se han descrito aumentos reversibles de las concentraciones séricas de litio y toxicidad.
No hay antecedentes del uso concomitante del valsartán con el litio. Por consiguiente, se aconseja controlar las concentraciones séricas de litio durante el uso simultáneo.
En la monoterapia con valsartán no se hallaron interacciones farmacológicas de importancia clínica con los fármacos siguientes: cimetidina, warfarina, furosemida, digoxina, atenolol, indometacina, hidroclorotiazida, amlodipino, glibenclamida.
Debido al componente tiazídico de CO-DIOVAN®, se pueden producir las siguientes interacciones farmacológicas: Las tiazidas potencian la acción de los derivados del curare.
La administración simultánea de antiinflamatorios no esteroideos (por ejemplo, derivados del ácido salicílico, indometacina) puede atenuar la actividad diurética y antihipertensora del componente tiazídico de CO-DIOVAN®. La hipovolemia concomitante puede inducir una insuficiencia renal aguda.
Los diuréticos caliuréticos, los corticosteroides, la adrenocorticotropina, la anfotericina, la carbenoxolona, la penicilina G y los derivados del ácido salicílico pueden incrementar el efecto hipocalemiante de los diuréticos.
Entre los efectos indeseados inducidos por las tiazidas figuran la hipocaliemia o hipomagnesemia, que favorecen la aparición de arritmias cardiacas inducidas por los digitálicos.
Puede ser necesario reajustar las dosis de insulina y de los hipoglucemiantes orales.
La coadministración de diuréticos tiazídicos puede incrementar la incidencia de reacciones de hipersensibilidad al alopurinol, el riesgo de efectos adversos causados por la amantadina, potenciar el efecto hiperglucemiante del diazóxido, y reducir la excreción renal de fármacos citotóxicos, como la ciclofosfamida o el metotrexato, y potenciar sus efectos mielosupresores.
Los agentes anticolinérgicos, como la atropina y el biperideno, pueden incrementar la biodisponibilidad de los diuréticos tiazídicos, al parecer debido a la disminución de la motilidad gastrointestinal y de la velocidad de vaciamiento gástrico.
En la literatura médica se han descrito casos de anemia hemolítica con el empleo simultáneo de la hidroclorotiazida y la metildopa.
La colestiramina reduce la absorción de diuréticos tiazídicos.
La administración de diuréticos tiazídicos con vitamina D o sales de calcio puede potenciar la elevación del calcio sérico.
El tratamiento concomitante con ciclosporina puede incrementar el riesgo de hiperuricemia y complicaciones gotosas. |
| ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO |
Hallazgos de laboratorio: Se han observado reducciones del potasio sérico superiores al 20% en el 2.2% de los pacientes tratados con CO-DIOVAN®, frente al 3.3% de los tratados con placebo.
En los ensayos clínicos controlados se han producido elevaciones de la creatinina en el 1.4% de los pacientes tratados con CO-DIOVAN® y en el 1.1% de los tratados con placebo. |
| PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD |
No se ha investigado la mutagenicidad, la clastogenicidad ni el poder cancerígeno de la asociación valsartán-hidroclorotiazida dado que no existen pruebas de interacción entre ambos compuestos, y que las pruebas de potencial mutágeno, clastógeno o cancerígeno del valsartán o de la hidroclorotiazida por separado dieron resultados negativos. |
| DOSIS Y VÍA DE ADMINISTRACIÓN |
Oral.
La dosis recomendada de CO-DIOVAN® es de una tableta recubierta al día.
Cuando sea pertinente desde el punto de vista clínico, pueden utilizarse las dosis de 80 mg de valsartán y 12.5 mg de hidroclorotiazida o de 160 mg de valsartán y 12.5 mg de hidroclorotiazida.
Si fuera necesario puede utilizarse la dosis de 160 mg de valsartán y 25 mg de hidroclorotiazida. El máximo efecto antihipertensor se observa en un plazo de 2 a 4 semanas.
No se necesitan ajustes de la dosis en pacientes con deterioro leve a moderado de la función renal (depuración de creatinina > 30 ml/min).
No se necesitan ajustes de la dosis en pacientes con insuficiencia hepática leve a moderada de origen no biliar y sin colestasis (véase Precauciones generales).
No se ha establecido la seguridad y eficacia de CO-DIOVAN® en niños. |
| MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL |
La sobredosis con valsartán puede resultar en una marcada hipotensión que lleva a depresión del estado de conciencia, colapso circulatorio y choque. Si la ingestión es reciente, se debe inducir el vómito; de lo contrario, el tratamiento habitual debería ser una infusión intravenosa de solución fisiológica.
Al contrario de la hidroclorotiazida, que se elimina por diálisis, el valsartán no se puede eliminar por hemodiálisis debido a su fuerte unión a las proteínas plasmáticas. |
| PRESENTACIONES |
Frasco con 7, 14, 28 y 42 tabletas con 80 mg/12.5 mg.
Frasco con 7, 14, 21 y 28 tabletas con 160 mg/12.5 mg.
Frasco con 7, 14 y 28 tabletas con 160 mg/25 mg. |
| RECOMENDACIONES SOBRE ALMACENAMIENTO |
Consérvese a temperatura ambiente a no más de 30°C. Consérvese el frasco bien tapado. |
| LEYENDAS DE PROTECCIÓN |
No se use en el embarazo ni en la lactancia.
No se deje al alcance de los niños.
Para mayor información comuníquese al Centro de Atención a Clientes de Novartis Farmacéutica, S. A. de C. V., Calzada de Tlalpan Núm. 1779, Col. San Diego Churubusco, Coyoacán, C.P. 04120, Tel: 5420-8685, en el interior de la República 01 800 718-5459.
Hecho en Suiza por:
Novartis Pharma AG.
Acondicionado y distribuido por:
NOVARTIS FARMACÉUTICA, S. A. de C. V.
Reg. Núm. 355M98, SSA IV
KEAR-05330020510588/RM2005
BPI: 15.6.2005 NPI: 04.08.05 |
|
|